
免疫組織化学的検査:概要+IHC染色を改善するためのステップ


免疫組織化学的検査概論
免疫組織化学的検査(IHC)は、正確な腫瘍の分類と診断に役立つ特異的なタンパク質マーカーの存在を検出するために、組織学的検査で使用されます。このガイドでは、IHC染色を行う際の基本的な手順について説明します。
IHC染色の概要
免疫組織化学的検査(IHC)は、正確な腫瘍の分類と診断に役立つ特異的なタンパク質マーカーの存在を検出するために、組織学的検査で使用されます。免疫組織化学的検査は、組織の形態(構造)を示すために一般的に使用される ヘマトキシリン・エオシン(HE)および特殊染色の技術を補完するように進化してきました。HEや特殊染色は非特異的ですが、IHCは特異的なタンパク質マーカーを対象にします。IHCは、固形腫瘍や細胞診標本の診断を支援する診断ツールとして使用されており、ほぼ半世紀にわたって主流の診断ツールとして使用されてきました。
標的抗原
抗原とは、細胞内または細胞表面に存在するタンパク質のことです。病理医は、診断を支援するために、特定の抗原の有無を調べます。
診断に役立つことがわかっている抗原は何百種類もあります。多くの場合、病理医は、特定の腫瘍を完全に分類するために、複数の抗原の「パネル」を使用します。
一次抗体
IHCの最初の段階は、標的抗原に特異的に結合する一次抗体の適用です。
抗体には大きく分けてポリクローナル抗体とモノクローナル抗体の2種類があります。ポリクローナル抗体は、標的抗原の複数のエピトープ(すなわち部分)と親和性があり、結合するため、非標的抗原と交差反応を起こしやすくなっています。
モノクローナル抗体は、1つのエピトープのみに親和性があり、よりクリーンで、より特異的な染色を行う傾向がありますが、感度や強度は低下します。
二次抗体
次に、二次抗体が一次抗体に結合します。これは間接IHCとして知られています。複数の二次抗体が1つの一次抗体に結合して染色強度を増幅することができるので、現在では一般的に使用されています。
検出システム
検出システムは二次抗体に対して構築されています。最新の発色検出では、抗体に結合させた西洋ワサビペルオキシダーゼ(HRP)などの酵素が利用されています。抗体に結合した複数の酵素はポリマーとして知られており、色素が付着する分子が多くなるので、これによっても、より強い染色が可能になります。
色素
最後に、基質は、顕微鏡で可視化することができる不溶性の着色沈殿物を形成します。一般的に使用されている色素原は2種類あります:DAB(茶色)または赤色色素
DABは、強力で永続的な染色を提供するため、ほとんどのアプリケーションで使用されています。赤色色素は主に、茶色のDABが茶色のメラニン色素で隠されてしまう可能性のある皮膚切片で使用されます。
病理医が1枚のスライド上で2つの抗原を視覚化できるように、DABとAPレッドの両方が同じ組織切片で使用されることがあります。これは二重染色と呼ばれるプロセスです。
完了したIHC染色
これは典型的なIHC染色であり、茶色の沈殿物が標的抗原の存在を示しています(この例では前立腺生検でのサイトケラチン5)。染色量、染色パターン、染色位置(細胞質、細胞核、または細胞膜)はすべて、診断を行う病理医に情報を提供します。
青いバックグラウンドは ヘマトキシリン の対比染色で、色素の後に適用されることが多いです。対比染色は色素とのコントラストを提供し、病理医が根底にある組織構造を視覚化するのにも役立ちます。
IHCを改善するための15のステップ
患者から病理医まで、組織学的検査のために組織標本を調製するには、細心の注意と技術、および適切な手順が必要です。このガイドでは、ベストプラクティスのテクニックと、良くあるエラーを回避するための簡単な方法について、実践的なアドバイスを提供します。
このセクションでは、IHCを改善するためのヒントを取り上げます。各手順が、良い組織学的検査を行う上での重要な注意喚起となり、好ましくない結果が発生した場合のトラブルシューティングとしても役立つことを願っています
組織学的検査を改善する101のステップ」をすべてご覧になりたい方は・・・
ステップ1‐高品質の切片を使用する
スライド上で完全に乾燥させた薄くて平らな切片を使用するように特に注意してください。IHCには、帯電したスライドまたはAPSでコーティングされたスライドを使用することをお勧めします。
不均一で接着が不十分な切片は、バックグラウンド染色が変化しやすく不均一に染色されます。
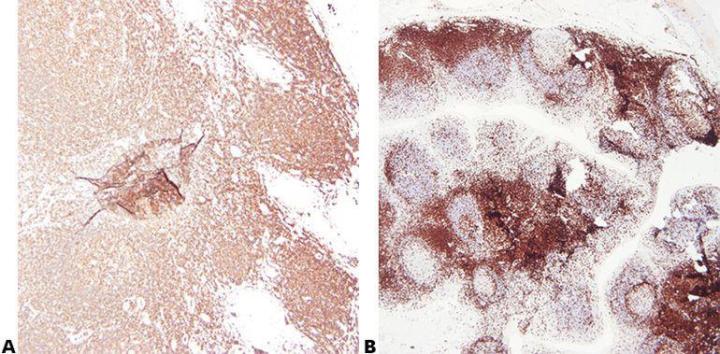
ステップ2‐最適な固定を確保する
既知の一貫した固定条件(固定剤の種類、pH、温度、時間)を使用した高品質の固定により、最良の結果が得られます。処理の前に標本をチェックして、固定の追加が必要かどうかを判断する必要があります。
固定条件に一貫性がないと、固定不足または固定過剰の組織が生成され、結果がばらつき、トラブルシューティングが困難になります。

ステップ3‐切片の接着の問題を回避する
特に帯電したスライドでは、浮遊槽で、タンパク質ベースの切片接着剤(接着剤、でんぷん、ゼラチン)を使用することを避けてください。
タンパク質ベースの接着剤は、帯電したスライドの表面をブロックする可能性があります。このため、接着に一貫性がなくなり、浮き上がった切片の下にIHC試薬が溜まるため、染色が不均一になります。

ステップ4‐濃度勾配を避ける
試薬を注意深く滴下することにより、濃度勾配を回避します。
「スライドの一方の端が強く染色され、もう一方の端が弱く染色されることがあります。」
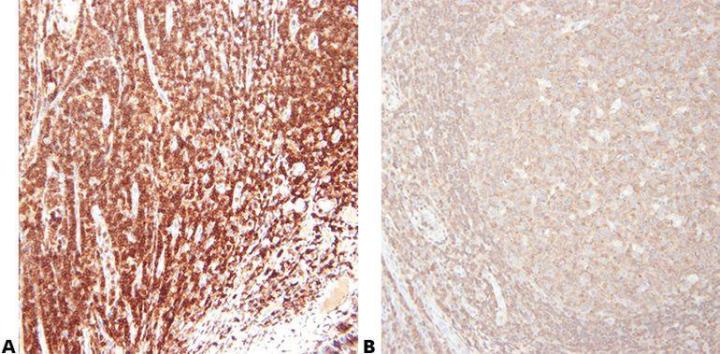
ステップ5‐抗体を慎重に選択する
一次抗体は、感度と特異性を考慮して、慎重に選択してください。異なるサプライヤーによって販売されている抗体は、多くの場合、同じ供給元からのものであり、再パッケージ化/ブランド化されて販売されていることに注意してください。抗体を評価する際には、クローン名を使用することが重要です。
「私たちは価格だけに基づいて抗体を購入します。」

ステップ6‐データシートを読む
自分の一次抗体を知っておきましょう。特定の抗体に関して使用している方法の適合性を判断するために、必ずデータシートを確認してください。新しい抗体のバッチを購入するときは、データシートを更新する必要があります。
「私たちの研究室では抗体データシートにアクセスできません。」
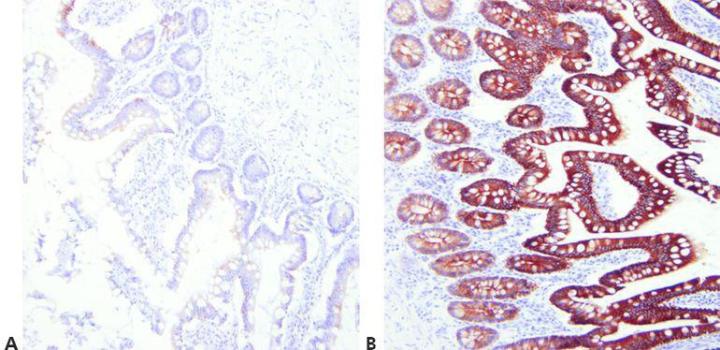
ステップ7‐賦活化法を最適化する
使用している一次抗体、染色している組織、および使用した固定法に応じてマスキング解除条件(pH、試薬、反応条件)を選択してください。
ユニバーサルな加熱処理法がうまくいっていることを前提として、すべての一次抗体に対して同じ賦活化法を使用します。
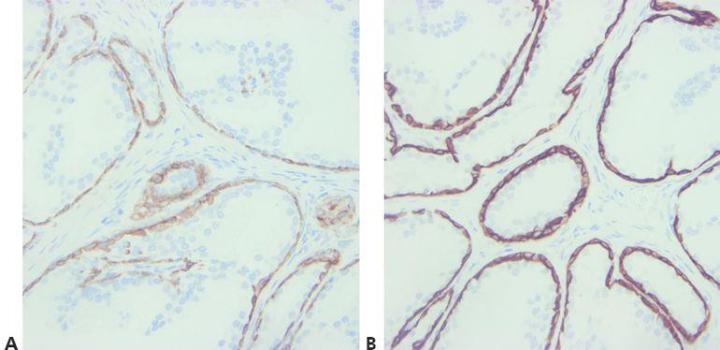
ステップ8‐抗体の交差反応を検討する
抗体の交差反応性に関する潜在的な問題に注意してください(データシートをお読みください)。
予想外の陽性染色を説明する試みはなされていません。
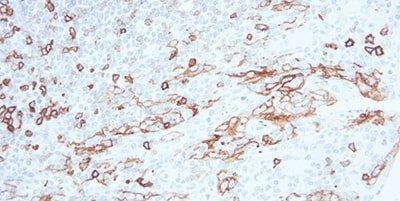
ステップ9‐内因性ペルオキシダーゼをブロックする
ペルオキシダーゼベースの検出システムでは、常にペルオキシダーゼブロッキングステップを使用してください。
非特異的染色が、赤血球、顆粒球、単球、筋肉に多く見られます。これは、内因性ペルオキシダーゼのブロックが不完全であるためです。
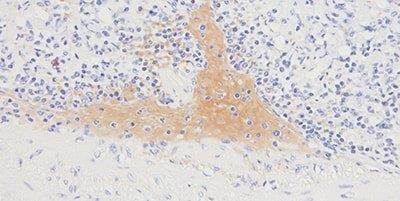
ステップ10-バックグラウンド染色を回避する
適切なタンパク質ブロックが常に使用されます。
タンパク質ブロックが効果的でないため、全体的にバックグラウンド染色が見られることがあります。

ステップ11‐適切な検出システムを使用する
正確で特異的な染色を適切な感度で提供する、適切な検出システムを選択してください。
「私たちは長い間同じ検出システムを使用しており、変更する理由はありません。時々、染色は弱く、私たちが期待するほど鮮明ではありません。」
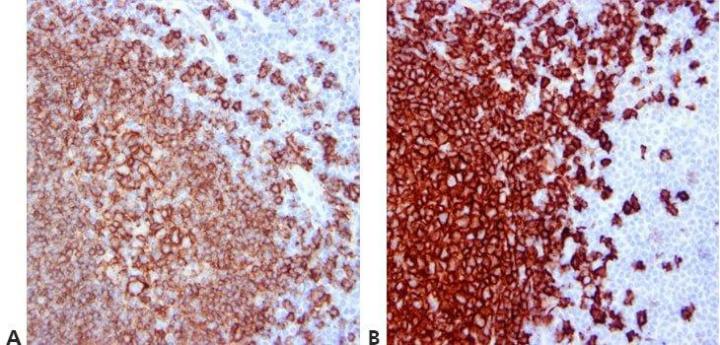
ステップ12‐洗浄ステップを標準化する
全体を通して、標準化された洗浄ステップを使用してください(攪拌の持続時間、量、および形態)。これにより、結果の一貫性が保証されます。
同じ抗体を使用して実施した染色内でも、また、異なる日に実施した染色間でも、結果は大きく変動します。これは、異なるオペレーターが異なる洗浄技術を使用することが原因である可能性があります。
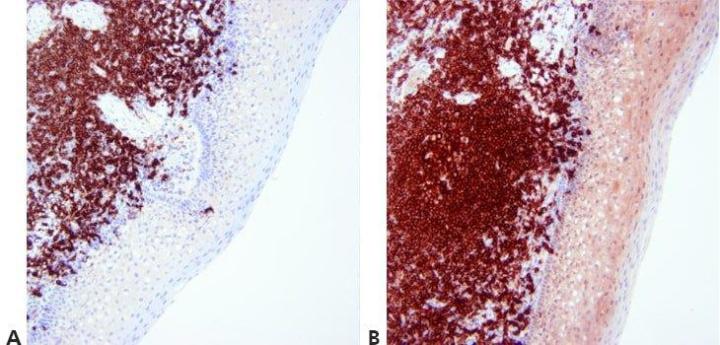
ステップ13‐対比染色を最適化する
陽性染色が不明瞭にならないように、核の対比染色のレベルを注意深く調整し、標準化します。対比染色は、色素とバックグラウンド組織成分の間で可能な限り最高のコントラストを提供する必要があります。使用する色素に適した対比染色を選択します。
核の対比染色が非常に強いことがあります。これにより、弱く特異的な染色が不明瞭になる可能性があります。
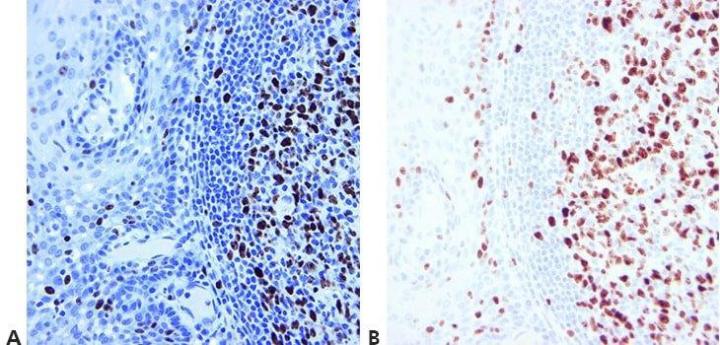
ステップ14‐適切な対照を使用する
陽性・陰性の対照を常に使用して、これらを注意深く調べ、結果を検証してください。内部の陽性・陰性の対照も重要であり、IHCの品質保証を確保する優れた手段を提供します。
「私たちの方法がうまくいっていないと思われる場合にのみ、対照を実施します。染色するたびに対照を実施しても、わざわざそれらの結果を見ることはないでしょう。」
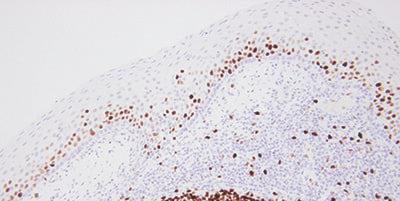
ステップ15‐結果を注意深く評価する
染色後に検査切片と対照を評価する際に、何を探すべきか、どこを探すべきかを理解してください。
検査切片で染色が観察されれば、染色は十分であると見なします。
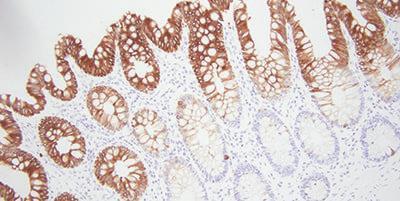
プラスのヒント:適切な抗体の選択
単純ですが、見過ごされがちなステップは、免疫組織化学的検査に有効な抗体を選択することです。これにより、将来の頭痛の種を大幅に減らすことができるかもしれません。文献、ベンダー、および同僚から特異的な抗体の情報を集めてください。
抗体に関して心に留めておくべきことがいくつかあります。ある研究室でうまくいったとしても、あなたの検査室にとっては最適ではないかもしれません。それぞれの抗体は、あなたの染色システムでテストする必要があります。時間が経つと抗体は染色強度を失う可能性があります。空気や光にさらされることが、この原因になる可能性があります。
濃縮液とRTU抗体
抗体を選択する際には、考慮すべき2つの主な選択肢があります。濃縮フォーマットまたは事前に希釈されたReady-To-Use(RTU)フォーマットです。濃縮液は柔軟性があり、初期購入価格が安く、通常、メーカーの推奨に従えば、自動・手動を問わず、あらゆる染色システム内で使用できます。濃縮液の作業希釈は、コスト、染色時間、品質のバランスをとるために最適化することができます。作業希釈範囲が広いため、濃縮液はいつでも変更することができ、検査室での使用方法の変更や特定の抗体に対する複数のプロトコールに対応できます。しかし、濃縮液は、準備時間と検証が必要です。十分に管理された試験を実施しない限り、希釈抗体の特性や安定性を決定する確実な方法がないので、微妙な劣化に気付かずに、染色品質が損なわれる可能性があります。RTUの利点には、検査室の効率の向上、品質管理の向上、試薬管理の容易さなどがあります。これにより、作業希釈、調製、アッセイの検証にかかる時間を省くことができます。一貫性は、特に自動染色装置と関連検出システムとを組み合わせて、実行ごとの変動を減らすことで強化されます。定義された検査の数とメーカーが確認した有効期限により、RTUは抗体管理を簡素化します。さらにRTUでは、検証作業の量が大幅に削減されるため、新しい抗体アッセイの導入が容易になり、検査室の成長に貢献することができます。
ボーナスのヒント:染色前の標準化は重要です
いかなる病理医、ラボマネージャー、組織技術者も、IHC染色の準備が始まるのは組織が取得された瞬間である、ということに異存はないでしょう。文献には、形態と抗原性が維持されることを保証するために、 組織固定、処理、切片作成の最適条件が記載されています。これらの因子を正しく制御するために、一貫性の維持に関してさらなる改善を追求することができます。これには、サンプルの受け入れと調製がここから始まることを考えると、サンプルの収集場所で確立している検査室が関与する可能性があります。
自動化されたアクセション、LIS、 サンプル追跡のインフラストラクチャ は、検査から手術/生検ポイントまで拡張され標準化された前処理装置(「制御された」ポット、固定液)をモニターして、下流での最適な処理を可能にする必要があります。この価値を認めた並行業界には血液検体を用いた検査室があり、追跡とアクセッションのために、バーコード化された患者情報を備えた、標準化されコーティングされた採血バイアルを利用しています。
固定、組織処理、IHC染色をリンクすることで、品質管理に付加価値が生まれます。固定および組織処理の状況をモニターして記録し、これらをIHC染色プロトコールとリンクすることのできる検査室は、より厳格な品質管理環境下で、診断が報告できるようになります。前処理の変動性に対する頻繁なコントロール(例えば、100枚のスライドごとのコントロール)も、染色機器の許容誤差と性能に関する良い尺度になるかもしれません。これらのワークフローとテクノロジーは、IHC業界が成熟するにつれて進化するでしょう。しかし、IHC染色から得られた高品質で一貫性のある結果を、確立し維持することが知られている、多くの優れた方法があります(表)。
| プロセス | 場所 | IHC に影響を与える一般的な問題 |
|---|---|---|
|
切除/生検 |
外科/医局 |
»» 切除装置によって損傷した機械的組織 |
|
検体受付 |
検査室 |
»» サンプルの誤ったラベル付け |
|
目視検査 |
検査室 |
»» 厚すぎる切片 |
|
組織片処理 |
検査室 |
»» 不十分な脱灰(必要な場合) |
|
包埋 |
検査室 |
»» 向きの間違い |
|
ミクロトーム |
検査室 |
»» 品質の悪いナイフまたは不適切なナイフプロファイル |
|
浮遊槽 |
検査室 |
»»汚れた水または汚染された水 |
About the presenters

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.

Steven Westra is a renowned antibody staining consultant with over ten years of experience in the immunohistochemistry industry.
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.