Una introducción a la preparación de muestras

Hay muchas razones para examinar células y tejidos humanos al microscopio. La investigación médica y biológica está respaldada por el conocimiento de la estructura y función normales de las células y tejidos y los órganos y estructuras que componen. En su estado sano normal, las células y otros elementos tisulares se organizan en patrones regulares y reconocibles. Los cambios inducidos por una amplia gama de influencias químicas y físicas se reflejan mediante alteraciones en la estructura a nivel microscópico, y muchas enfermedades se caracterizan por anomalías estructurales y químicas típicas que difieren del estado normal. La identificación de estos cambios y su vinculación con enfermedades particulares es la base de la histopatología y la citopatología, importantes especializaciones de la medicina moderna. La microscopía desempeña un papel importante en la hematología (el estudio de la sangre), la microbiología (el estudio de microorganismos, incluidos parásitos y virus) y, más ampliamente, en las áreas de biología, zoología y botánica. En todas estas disciplinas, las muestras se examinan con un microscopio.
Microscopía
Hay muchas formas diferentes de microscopía, pero la más utilizada es la microscopía de “campo claro”, donde la muestra se ilumina con un haz de luz que pasa a través de ella (en lugar de un haz de electrones como en la microscopía electrónica). Los requisitos generales para que una muestra se examine correctamente mediante microscopía de campo claro son:
- Que las células y otros elementos de la muestra se conserven en estado “similar al de la vida” (este proceso se denomina “fijación”)
- Que la muestra sea transparente en lugar de opaca, de modo que la luz pueda pasar a través de ella
- Que la muestra sea delgada y plana, de modo que solo contenga una capa de células
- Que algunos componentes se hayan coloreado (teñido) de forma diferenciada para que puedan distinguirse claramente
Opciones de preparación
Debido a los requisitos de microscopía, las opciones para preparar las muestras están limitadas a las siguientes:
- Montajes completos, donde un organismo o estructura completo es lo suficientemente pequeño o lo suficientemente delgado como para colocarse directamente en un portaobjetos de microscopio (p. ej., un pequeño organismo unicelular o multicelular o una membrana que se puede estirar finamente sobre un portaobjetos)
- Preparaciones “de aplastamiento”, en las que las células se aplastan intencionadamente en un portaobjetos para revelar su contenido (p. ej., muestras botánicas en las que las células se rompen para revelar cromosomas)
- Frotis, en los que la muestra consta de células suspendidas en un líquido (p. ej., sangre, semen, líquido cefalorraquídeo o un cultivo de microorganismos) o en los que las células individuales se han raspado, cepillado o aspirado (succionado) de una superficie o de un órgano (citología exfoliativa). Los frotis son la base de la conocida “prueba de Papanicolaou”, que se utiliza para detectar el cáncer cervicouterino en mujeres.
- Cortes en los que las muestras cuentan con alguna forma de soporte para que se puedan cortar cortes muy finos de ellas, montar la preparación en el portaobjetos y teñirse. Las secciones se preparan utilizando un instrumento llamado “microtomo”.
De estas opciones, solo los montajes completos y las secciones conservan las relaciones estructurales entre células individuales y componentes extracelulares. Las preparaciones de frotis y de aplastamiento proporcionan detalles sobre células individuales y números de células relativos, pero se pierden las relaciones estructurales. La preparación de secciones es el método más complicado desde el punto de vista técnico de estos métodos, ya que requiere equipos especializados y una experiencia considerable. El examen microscópico de las secciones por parte de un patólogo forma la piedra angular del diagnóstico de cáncer. Aunque la metodología para preparar secciones de material animal y vegetal es similar, la siguiente descripción se refiere a tejidos animales (humanos).
Preparación de la sección
La mayoría de los tejidos frescos son muy delicados, y se deforman y dañan con facilidad. Por lo tanto, es imposible preparar secciones finas (cortes) a partir de ellos a menos que sea con algún tipo de soporte mientras se corta. Por lo general, la muestra también debe conservarse o “fijarse” antes de preparar las secciones. En términos generales, hay dos estrategias que se pueden emplear para proporcionar este soporte.
1.El tejido puede congelarse rápidamente y mantenerse congelado mientras se cortan secciones con un microtomo de criostato (un microtomo en una cámara de congelación). Estas se denominan “secciones congeladas”. Las secciones congeladas se pueden preparar muy rápidamente y, por tanto, se utilizan cuando se requiere un diagnóstico intraoperatorio para guiar un procedimiento quirúrgico o cuando se debe evitar cualquier tipo de interferencia con la composición química de las células (como en algunas investigaciones histoquímicas).
2.Alternativamente, las muestras pueden infiltrarse con un agente líquido que posteriormente puede convertirse en un sólido que tiene propiedades físicas apropiadas que permitirán cortar secciones finas de él. Se pueden utilizar varios agentes para infiltrar y soportar las muestras, incluidas las resinas epoxi y metacrilato, pero las ceras histológicas basadas en parafina son las más populares para la microscopía óptica de rutina. Esto produce las llamadas “secciones de parafina”. Estas secciones se suelen preparar con un microtomo “de rotación”. “De rotación” describe la acción de corte del instrumento. En todos los laboratorios de histopatología, las secciones de parafina se preparan de forma rutinaria a partir de casi todas las muestras y se utilizan en el diagnóstico.
Los siguientes párrafos describen los pasos principales en la preparación de secciones de parafina. Estos pasos generalmente dictan el diseño y el flujo de trabajo en grandes laboratorios especializados en histopatología donde se manipulan cientos de muestras cada día.


Recepción de las muestras
Las muestras recibidas para el examen histológico pueden proceder de una serie de fuentes diferentes. Estas van desde muestras muy grandes u órganos completos hasta fragmentos de tejido diminutos. Por ejemplo, los siguientes son algunos de los tipos de muestras que se suelen recibir en un laboratorio de histopatología.
- Muestras de escisión (biopsias quirúrgicas), donde se extraen órganos enteros o áreas afectadas en el momento de la operación
- Muestras de biopsia cutáneas, en las que se extrae tejido para el diagnóstico de una zona afectada
- Biopsias con sacabocados, en las que se utilizan bisturís circulares para extraer una pequeña porción de tejido sospechoso para su examen (a menudo de la piel)
- Biopsias por raspado, donde pequeños fragmentos de tejido se “raspan” de una superficie (normalmente de la piel)
- Curetaje, en el que el tejido se retira en pequeños fragmentos del revestimiento del útero o del cuello uterino
- Biopsias centrales, en las que se extrae una pequeña muestra de tejido con una aguja especial, a veces a través de la piel (percutáneamente)
Las muestras se suelen recibir en un fijador (conservante), pero a veces llegan frescas y deben fijarse inmediatamente. Antes de que un laboratorio acepte las muestras, se comprobará cuidadosamente la identificación (etiquetado) y la documentación adjunta, se registrarán todos los datos y se iniciará el “seguimiento de las muestras”. Es vital que las muestras de pacientes o de investigación se identifiquen correctamente y que se minimice el riesgo de imprecisiones.
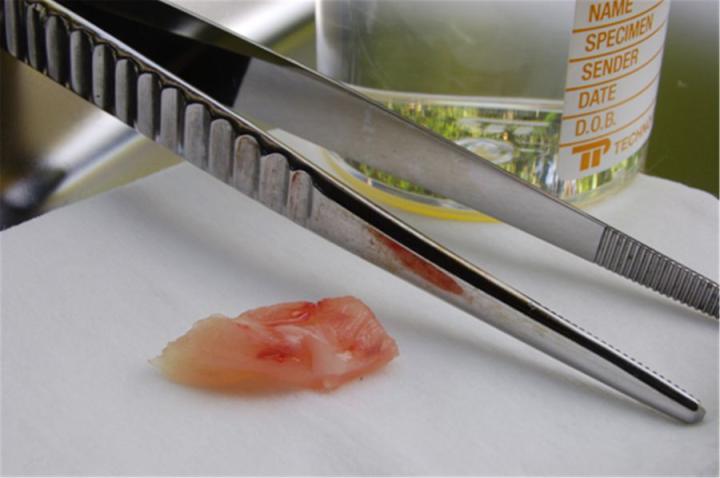
Fijación
La fijación es un paso crucial en la preparación de muestras para el examen microscópico. Su objetivo es evitar la descomposición y preservar las células y los tejidos en un estado “similar al de la vida”. Esto se consigue deteniendo la actividad enzimática, matando microorganismos y endureciendo la muestra mientras se mantiene una estructura molecular suficiente para permitir la aplicación de métodos de tinción adecuados (incluidos los que implican reacciones antígeno-anticuerpo y los que dependen de la conservación del ADN y el ARN). Cuanto antes se inicie la fijación tras la separación de una muestra de su riego sanguíneo, mejor será el resultado. El agente fijador más popular es el formaldehído, normalmente en forma de solución tamponada con fosfato (a menudo denominado “formol”). Idealmente, las muestras deben fijarse mediante inmersión en formol de seis a doce horas antes de ser procesadas.

Examen macroscópico
El examen macroscópico, a menudo denominado “corte”, implica un examen cuidadoso y una descripción de la muestra que incluirá el aspecto, el número de trozos y sus dimensiones. Las muestras más grandes pueden requerir una mayor disección para producir partes representativas de las zonas apropiadas. Por ejemplo, se pueden tomar varias muestras de los márgenes de escisión de un tumor para asegurarse de que el tumor se haya eliminado completamente. En el caso de muestras pequeñas, se puede procesar toda la muestra. Los tejidos seleccionados para el procesamiento se colocarán en casetes (pequeñas cestas perforadas) y los lotes se cargarán en un procesador de tejidos para el procesamiento hasta la parafina.
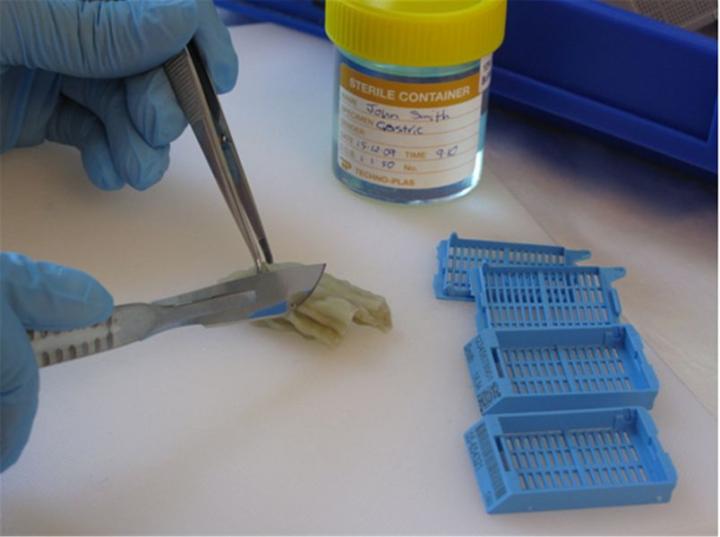
Procesamiento
Cuando se procesan grandes lotes de muestras para la preparación de secciones de parafina, se utilizan instrumentos automatizados denominados “procesadores de tejidos”. Estos instrumentos permiten infiltrar las muestras con una secuencia de diferentes disolventes que terminan en parafina derretida. Para empezar, las muestras se encuentran en un entorno acuoso (basado en agua) y deben someterse a múltiples cambios de disolventes deshidratantes y aclaradores (normalmente etanol y xileno) antes de que puedan colocarse en parafina fundida (que es hidrofóbica e inmiscible con agua). La duración y los detalles del paso del “programa de procesamiento” elegido para un lote concreto de muestras dependerán de la naturaleza y el tamaño de las muestras. Las programaciones pueden ser de tan solo una hora para muestras pequeñas o de hasta doce horas o más para muestras grandes. En muchos laboratorios, la mayor parte del procesamiento se realiza durante la noche. En la actualidad, existe una presión considerable sobre los laboratorios para utilizar procesadores rápidos en un esfuerzo por mejorar el flujo de trabajo y reducir los tiempos de procesamiento.

Inclusión
Tras el procesamiento, las muestras se colocan en un centro de inclusión, donde se retiran de sus casetes y se colocan en moldes rellenos de parafina. En esta fase, las muestras están cuidadosamente orientadas porque esto determinará el plano a través del cual se cortará la sección, lo cual, puede acabar determinando si un área anormal será visible en el microscopio. El casete en el que se ha procesado el tejido lleva los detalles de identificación de la muestra, y ahora se coloca sobre el molde y se fija añadiendo más parafina. El “bloque” de la muestra ahora se solidifica en una superficie fría y, cuando se haya asentado, se retira el molde. El casete, ahora lleno de cera y formando parte del bloque, proporciona una base estable para la sujeción en el micrótomo. El bloque que contiene la muestra ya está listo para ser cortado.

Corte
Las secciones se cortan en un instrumento de precisión llamado “microtomo” con hojas de acero extremadamente finas. Las secciones de parafina se cortan normalmente con un grosor de 3 - 5 μm, lo que garantiza que solo incluyan una sola capa de células (un eritrocito tiene un diámetro de aproximadamente 7 μm). Una de las ventajas de la cera de parafina como agente de inclusión es que a medida que se cortan las secciones, estas se pegan de borde a borde, formando una “cinta” de secciones. Esto facilita la manipulación.
Ahora las secciones se “ponen a flotar” sobre la superficie de agua caliente en un baño de flotación para aplanarlas y luego se recogen en preparaciones de microscopio. Después de un secado completo, están listas para la tinción.


Tinción
Aparte de algunos pigmentos naturales como la melanina, las células y otros elementos que componen la mayoría de las muestras son incoloros. Para poder revelar los detalles estructurales mediante microscopía de campo claro, se requiere cierta tinción. La tinción rutinaria utilizada universalmente como punto de partida para proporcionar información estructural esencial es la tinción con hematoxilina y eosina (H&E). Con este método, los núcleos celulares se tiñen de azul, y el citoplasma y muchos componentes extracelulares en tonos de rosa. En histopatología, muchas afecciones pueden diagnosticarse mediante una sola tinción de H&E. Sin embargo, a veces se requiere información adicional para proporcionar un diagnóstico diferencial completo, y esto requiere técnicas de tinción más especializadas. Estas pueden ser “tinciones especiales” que utilizan colorantes o impregnaciones metálicas para definir estructuras o microorganismos particulares, o métodos inmunohistoquímicos (IHC) que implican la localización de proteínas útiles desde el punto de vista diagnóstico mediante anticuerpos marcados. También pueden ser necesarios métodos moleculares como la hibridación in situ (ISH) para detectar secuencias específicas de ADN o ARN. Todos estos métodos pueden aplicarse a secciones de parafina y, en la mayoría de los casos, las preparaciones producidas son completamente estables y pueden conservarse durante muchos años
Después de la tinción, las secciones se cubren con un cubreobjetos de vidrio y luego se envían a un patólogo que las analizará con un microscopio para realizar un diagnóstico adecuado y preparar un informe.

About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Related Content
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.