
Inmunohistoquímica: Visión general y pasos a seguir para una mejor tinción IHC


La inmunohistoquímica (IHC) se utiliza en histología para detectar la presencia de un marcador proteico específico que pueda ayudar con la clasificación y el diagnóstico precisos del tumor. Esta guía ilustra los pasos básicos utilizados para crear una tinción IHC.
Introducción a la inmunohistoquímica
La inmunohistoquímica (IHC) se utiliza en histología para detectar la presencia de un marcador proteico específico que pueda ayudar con la clasificación y el diagnóstico precisos del tumor. Esta guía ilustra los pasos básicos utilizados para crear una tinción IHC.
Introducción a la tinción IHC
La inmunohistoquímica (IHC) se utiliza en histología para detectar la presencia de marcadores proteicos específicos que puedan ayudar con la clasificación y el diagnóstico precisos del tumor. La inmunohistoquímica ha evolucionado para complementar las técnicas de hematoxilina-eosina (H&E) y tinción especial que normalmente muestran la morfología (estructura) del tejido. Cuando la H&E y las tinciones especiales no son específicas, la IHC se dirige a un marcador o marcadores de proteína específicos. La IHC se utiliza como herramienta de diagnóstico para ayudar en el diagnóstico de tumores sólidos y muestras citológicas y se ha utilizado como herramienta de diagnóstico convencional durante casi medio siglo.
Antígeno diana
Los antígenos son proteínas que están dentro o en la superficie de una célula. Los patólogos buscan la presencia o ausencia de antígenos concretos para ayudar con el diagnóstico.
Se ha descubierto que muchos cientos de antígenos son útiles desde el punto de vista diagnóstico. Con frecuencia, un patólogo utilizará un “panel” de múltiples antígenos para clasificar completamente un tumor en particular.
Anticuerpo primario
La primera etapa de la IHC es la aplicación de un anticuerpo primario que se une específicamente al antígeno diana.
Existen dos tipos principales de anticuerpos: policlonales y monoclonales. Los anticuerpos policlonales tienen una afinidad con, y se unen a, varios epítopos (o partes de estos) o el antígeno diana, por lo que son más propensos a experimentar una reacción cruzada con antígenos no diana.
Los anticuerpos monoclonales tienen una afinidad a un solo epítopo y tienden a producir una tinción más limpia y específica, pero son menos sensibles o intensos.
Anticuerpo secundario
Después, los anticuerpos secundarios se unen al anticuerpo primario. Esto se conoce como IHC indirecta. Ahora se utiliza habitualmente, ya que se pueden unir varios secundarios a un solo primario para amplificar la intensidad de la tinción.
El sistema de detección
El sistema de detección se basa en el anticuerpo secundario. La detección cromogénica moderna utiliza enzimas como la peroxidasa de rábano picante (HRP) que se conjugan (unen) a un anticuerpo. A las múltiples enzimas unidas al anticuerpo se las conoce como polímeros, y estas producen una tinción más intensa, ya que hay más moléculas a las que se puede unir el cromógeno.
El cromógeno
Por último, un sustrato forma un precipitado de color insoluble que puede verse en un microscopio. Hay dos cromógenos de uso común: DAB (marrón) o AP (rojo)
DAB se utiliza para la mayoría de las aplicaciones, ya que proporciona tinciones fuertes y permanentes. AP rojo (u otro cromógeno rojo) se utiliza principalmente para secciones de piel en las que la DAB marrón puede enmascararse con el pigmento de melanina marrón.
Tanto DAB como AP rojo se utilizan a veces en la misma sección de tejido para permitir al patólogo visualizar dos antígenos en un lado. Este es un proceso conocido como tinción doble.
Una tinción IHC completada
Esta es una tinción IHC típica en la que el precipitado marrón indica la presencia del antígeno diana; en este caso, se trata de la citoqueratina 5 en una biopsia de próstata. La cantidad de tinción, el patrón de tinción y la ubicación de la tinción (núcleo del citoplasma celular o membrana) proporcionan información para el patólogo encargado del diagnóstico.
El fondo azul es una contratinción de hematoxilina que suele aplicarse después del cromógeno. La contratinción proporciona un contraste con el cromógeno y también ayuda al patólogo a visualizar la estructura tisular subyacente.
15 pasos para una mejor IHC
Desde el paciente hasta el patólogo, la preparación de muestras de tejidos para su examen histológico requiere cuidado, habilidad y un procedimiento delicado. Esta guía proporciona asesoramiento práctico sobre las mejores técnicas, así como formas sencillas de evitar errores comunes.
En esta sección de proporcionan algunos consejos para obtener una mejor IHC. Esperamos que cada paso proporcione un valioso recordatorio de buenas prácticas histológicas y ayude a solucionar problemas cuando se produzcan resultados inaceptables.
¿Desea ver los 101 pasos para una mejor histología?
¡Haga clic aquí para descargar ahora 101 pasos para una mejor histología!
Paso 1 - Usar secciones de alta calidad
Tenga especial cuidado de utilizar secciones finas y planas que se hayan secado por completo sobre la preparación. Utilice preferiblemente preparaciones cargadas o preparaciones recubiertas con APES para IHC.
Las secciones irregulares y mal adheridas se tiñen de forma irregular con tinción de fondo variable.
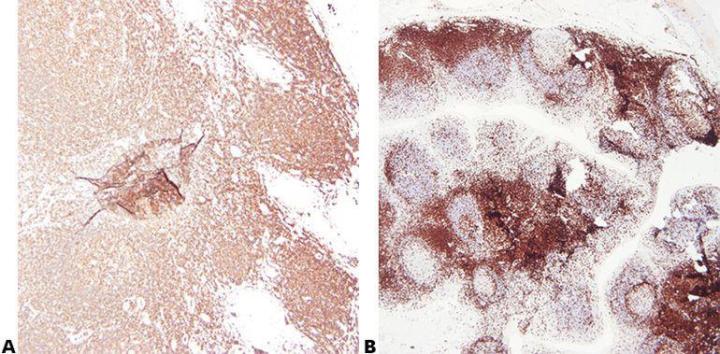
Paso 2 - Garantizar una fijación óptima
La buena calidad de la fijación con condiciones de fijación conocidas y constantes (tipo de fijador, pH, temperatura, tiempo) produce los mejores resultados. Se deben comprobar las muestras antes del procesamiento para determinar si es necesaria una fijación adicional.
Las condiciones de fijación inconstantes, que producen tejidos infrafijados o sobrefijados, producen resultados variables y dificultan la resolución de problemas.

Paso 3 - Evitar problemas de adherencia de la sección
Evite el uso de adhesivos de sección a base de proteínas en el baño de flotación (pegamento, almidón o gelatina), especialmente en preparaciones cargadas.
Los adhesivos a base de proteínas pueden bloquear la superficie de la preparación cargada. Esto provoca una adherencia incoherente y provoca una tinción irregular debido a la agrupación de reactivos para IHC por debajo de las secciones levantadas.

Paso 4 - Evitar gradientes de concentración
Los gradientes de concentración se evitan mediante la aplicación cuidadosa de los reactivos.
“A veces vemos una tinción fuerte en un extremo de la preparación que progresa a una tinción débil en el otro”.
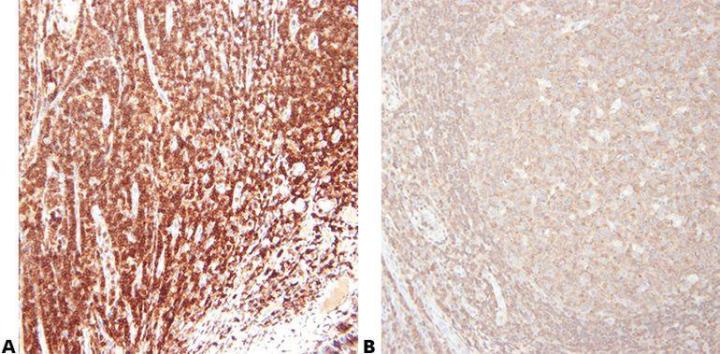
Paso 5 - Elegir el anticuerpo con cuidado
Elija su anticuerpo primario con cuidado en relación con su sensibilidad y especificidad. Tenga en cuenta que los anticuerpos vendidos por diferentes proveedores suelen proceder de la misma fuente y se reenvasan/etiquetan para su venta. Es importante utilizar el nombre del clon al evaluar un anticuerpo.
“Compramos nuestros anticuerpos solo en función del precio”.

Paso 6 - Leer las hojas de especificaciones
Conozca su anticuerpo primario. Compruebe siempre la hoja de especificaciones para determinar la idoneidad de su método para un anticuerpo concreto. Las hojas de especificaciones deben actualizarse cuando se compra un nuevo lote de anticuerpos.
“No tenemos acceso a las hojas de especificaciones de los anticuerpos de nuestro laboratorio”.
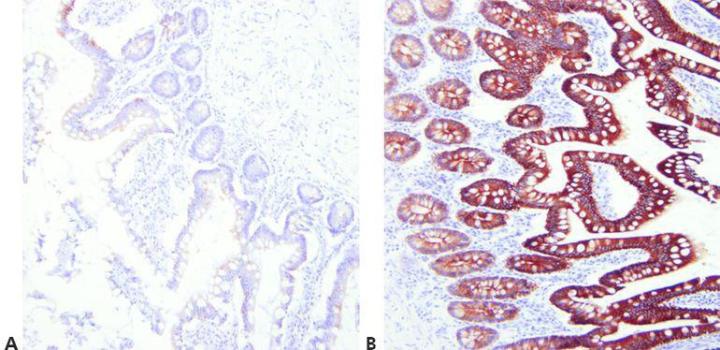
Paso 7 - Optimizar los métodos de recuperación
Elija las condiciones de desenmascaramiento adecuadas para el anticuerpo primario utilizado, el tejido teñido y la fijación empleada (pH, reactivo, condiciones de reacción).
Se utiliza la misma técnica de recuperación para todos los primarios suponiendo que existe un método HIER universal satisfactorio.
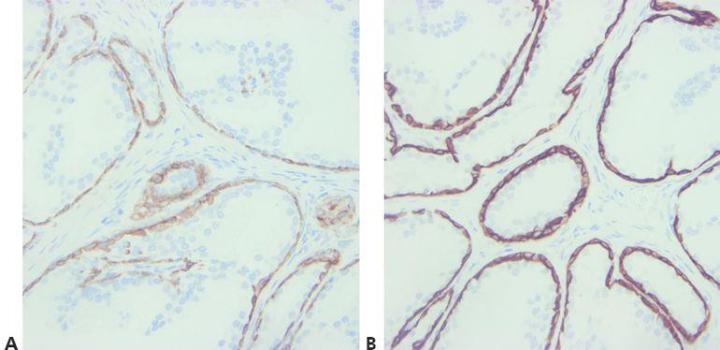
Paso 8 - Considerar la reactividad cruzada de anticuerpos
Conozca cualquier posible problema con la reactividad cruzada de anticuerpos (lea la hoja de especificaciones).
No se intenta explicar la tinción positiva inesperada.
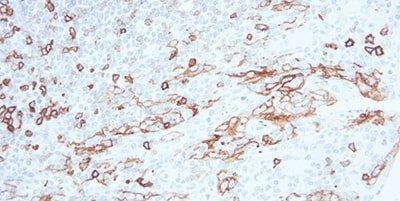
Paso 9 - Bloquear la peroxidasa endógena
Para los sistemas de detección basados en la peroxidasa, utilice siempre un paso de bloqueo de la peroxidasa.
Se suele observar una tinción inespecífica en eritrocitos, granulocitos, monocitos y en músculos. Esto se debe a una peroxidasa endógena bloqueada incompletamente.
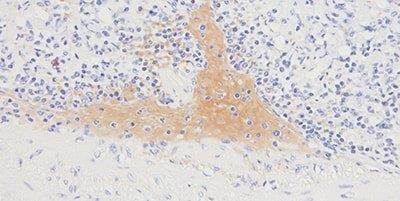
Paso 10 - Evitar la tinción de fondo
Siempre se utiliza el bloqueo de proteína adecuado.
La tinción de fondo generalizada se ve a veces debido a un bloqueo de proteína ineficaz.

Paso 11 - Usar un sistema de detección adecuado
Elija un sistema de detección adecuado que proporcione una tinción precisa y específica con la sensibilidad adecuada.
“Hemos estado utilizando el mismo sistema de detección durante mucho tiempo y no vemos ningún motivo para cambiar. A veces, nuestras tinciones son débiles y no tan nítidas como cabría esperar”.
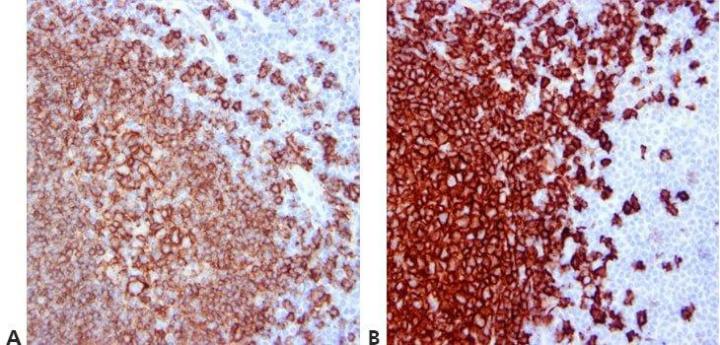
Paso 12 - Estandarizar los pasos de lavado
Utilice pasos de lavado estandarizados (duración, volumen y forma de agitación). Esto garantizará la coherencia de los resultados.
Los resultados son muy variables dentro de los ciclos con el mismo anticuerpo y entre ciclos en días diferentes. Esto puede deberse al uso de diferentes técnicas de lavado por parte de diferentes operadores.
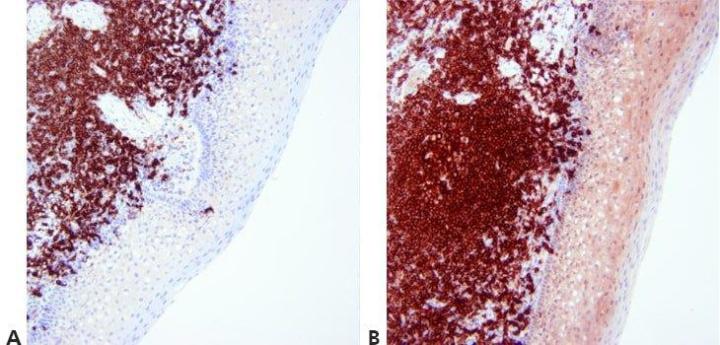
Paso 13 - Optimizar la contratinción
El nivel de contratinción nuclear se regula y estandariza minuciosamente para no oscurecer la tinción positiva. La contratinción debe proporcionar el mejor contraste posible entre el cromógeno y los elementos de tejido de fondo. Se elige una contratinción adecuada para el cromógeno utilizado
La contratinción nuclear a veces es muy fuerte. Esto puede oscurecer la tinción específica débil.
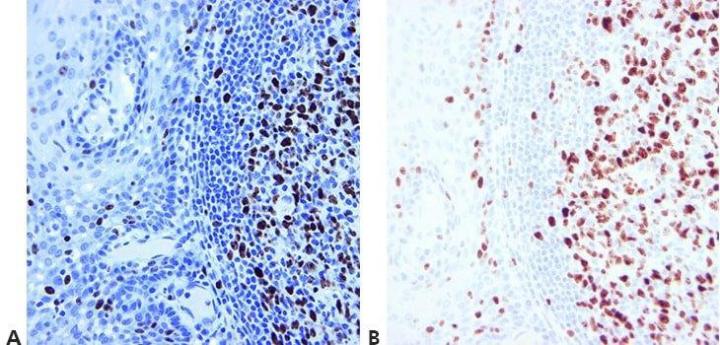
Paso 14 - Usar controles adecuados
Utilice siempre controles positivos y negativos adecuados que se examinen minuciosamente para validar los resultados. Los controles internos positivos y negativos también son importantes y proporcionan un medio excelente para garantizar la calidad en IHC.
“Solo hacemos controles cuando nuestro método no parece funcionar. Si los hiciéramos en cada ciclo, la gente no se molestaría en mirarlos”.
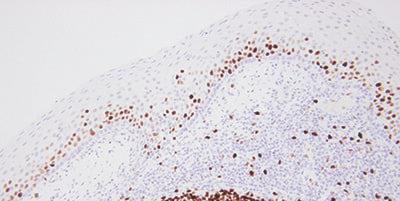
Paso 15 - Evaluar los resultados con atención
Sepa qué buscar y dónde mirar al evaluar sus secciones de prueba y controles después de la tinción.
Si se observa tinción en las secciones de prueba, se supone que las tinciones son satisfactorias.
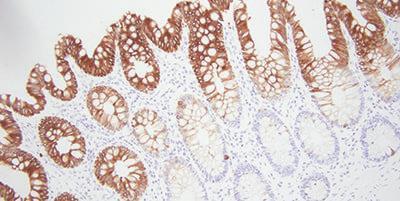
Consejo adicional: Cómo elegir los anticuerpos adecuados
Un paso sencillo, pero a veces ignorado, es elegir anticuerpos que funcionen para la inmunohistoquímica. Esto puede ahorrarle muchos dolores de cabeza durante el proceso. Busque anticuerpos específicos en la literatura, los proveedores y sus pares.
Hay varias cosas que hay que tener en cuenta con los anticuerpos. Lo que puede que funcione bien en un laboratorio podría no ser óptimo para su laboratorio. Cada anticuerpo debe analizarse con su sistema de tinción. Los anticuerpos pueden perder su intensidad de tinción con el tiempo. Esto puede deberse a la exposición al aire y a la luz.
Concentrados frente a anticuerpos RTU
Al seleccionar anticuerpos, hay dos opciones principales a tener en cuenta: un formato concentrado o un formato prediluido, listo para usar (RTU). Los concentrados son flexibles, tienen un precio de compra inicial más bajo y generalmente se pueden utilizar dentro de cualquier sistema de tinción, tanto automatizado como manual, sujeto a las recomendaciones del fabricante. La dilución de trabajo de los concentrados se puede optimizar para equilibrar el coste, el tiempo de tinción y la calidad. Debido a la amplia variedad de diluciones de trabajo, los concentrados pueden variarse en cualquier momento para adaptarse a los cambios en la práctica de laboratorio o para varios protocolos para un anticuerpo concreto. Sin embargo, los concentrados requieren tiempo de preparación y validación. Dado que no existe una forma definitiva de determinar las propiedades y la estabilidad de un anticuerpo diluido sin estudios bien controlados y ejecutados, la calidad de la tinción puede verse comprometida, ya que es posible que no se observen deterioros sutiles. Las ventajas de los RTU incluyen una mayor eficiencia en el laboratorio, un mejor control de calidad y una gestión más sencilla de los reactivos. Eliminan el tiempo dedicado a la dilución de trabajo, la preparación y el tiempo necesario para validar el ensayo. La uniformidad se mejora con la reducción de la variación entre tandas, especialmente en combinación con estaciones de tinción automatizadas y sistemas de detección asociados. Con un número definido de pruebas y una caducidad verificada por el fabricante, los RTU simplifican la gestión de anticuerpos. Además, los RTU pueden contribuir al crecimiento del laboratorio al facilitar la adopción de nuevos ensayos de anticuerpos, ya que la cantidad de trabajo de validación se reduce en gran medida.
Consejo adicional: La estandarización previa a la tinción es fundamental
Cualquier patólogo, director de laboratorio o histotécnico reconocerá fácilmente que la preparación para la tinción IHC comienza en el momento en que se adquiere el tejido. La bibliografía documenta las condiciones óptimas para la fijación, el procesamiento y el corte de tejidos para garantizar que se mantiene la morfología y la antigenicidad. Podrían buscarse más mejoras en el mantenimiento de la uniformidad para controlar correctamente estos factores. Esto puede implicar que un laboratorio se establezca en el lugar de la recogida de muestras, reconociendo que la entrada y la preparación de la muestra comienzan aquí.
La entrada automatizada, el LIS y la infraestructura de seguimiento de muestras no solo deben implicar al laboratorio, sino también durante la cirugía/punto de biopsia, permitiendo que el equipo de preparación estandarizado (recipientes “controlados”, fijadores) sea monitorizado para un procesamiento posterior óptimo. Una industria paralela que reconoció este valor es el laboratorio de análisis de sangre, que utiliza viales de recogida recubiertos estandarizados con información del paciente en código de barras para el seguimiento y la entrada.
La vinculación de la fijación, el procesamiento de tejidos y la tinción IHC añadirán valor en el control de la calidad. Los laboratorios que pueden supervisar y registrar las condiciones de fijación y procesamiento de tejidos y vincularlas con protocolos de tinción IHC podrán notificar un diagnóstico en un entorno con una calidad más controlada. El uso frecuente de controles para la variabilidad previa al procesamiento (p. ej., control cada 100 preparaciones) también puede proporcionar una buena medición para las tolerancias y el rendimiento del instrumento de tinción. Estos flujos de trabajo y tecnologías evolucionarán a medida que madura la industria de la IHC. Sin embargo, existen una serie de buenas prácticas que se sabe que establecen y mantienen resultados de alta calidad y uniformes de la tinción IHC (consulte la tabla siguiente).
| Proceso | Ubicación | Problemas comunes que afectan a la IHC |
|---|---|---|
|
Escisión/biopsia |
Cirugía/consulta del médico |
Tejido mecánico dañado por el equipo de escisión |
|
Adhesión |
Laboratorio |
Etiquetado incorrecto de las muestras |
|
Tallado |
Laboratorio |
Cortes demasiado gruesos |
|
Procesamiento de tejidos |
Laboratorio |
Descalcificación insuficiente (cuando sea necesaria) |
|
Inclusión |
Laboratorio |
Orientación incorrecta |
|
Microtomía |
Laboratorio |
Cuchilla de mala calidad o perfil de cuchilla incorrecto |
|
Flotación |
Laboratorio |
Agua sucia o contaminada |
¡Descargue ya los 101 pasos para una mejor histología!
About the presenters

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.

Steven Westra is a renowned antibody staining consultant with over ten years of experience in the immunohistochemistry industry.
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.