脱灰の手引き

脱灰とは、骨またはその他の石灰化した組織からミネラル分を除去する方法です。これにより、重要な微小成分を失わずに良質のパラフィン切片を作製することが可能になります。脱灰は、標本を完全に固定した後、通常のパラフィン処理前に実施します。本論文では、骨の基本構造を説明し、切片作製法の選択について概説します。脱灰の方法とその過程の適切な監視について考察し、よく使われている試薬をいくつかご紹介します。
はじめに
組織学者が、骨や他の石灰化標本から切片を作製することが必要になった場合、選択肢は多数存在します。技術や処理 方法を選択する際には、実施する検査のタイプを考慮する必要があります。例えば、代謝性骨疾患を検査する場合は、石灰化した骨を類骨から識別する必要があり、また、形態計測が必要な場合は、非脱灰骨の切片を作製することにより、ミネラル含有量を保持し示すことが必要になる場合があります。石灰化した骨は硬い材料なので、切片を作製するために利用できる技術の範囲は限られています。 固定 した後、直接薄い切片にし、さらに研磨面を用いて磨くことにより、薄い「研磨」切片を作製することができます(図1参照)。また、重合すると石灰化した骨と同等の硬さになる、アクリル樹脂またはエポキシ樹脂を浸透させた骨標本を作製することもできます。次に、この浸透させた標本から研磨切片を作製するか、強力なミクロトームとタングステンまたはダイヤモンドのナイフを用いて直接切片を作製することが可能です(図2参照)。石灰化した海綿骨の 凍結切片 の作製もまた可能です。1-3
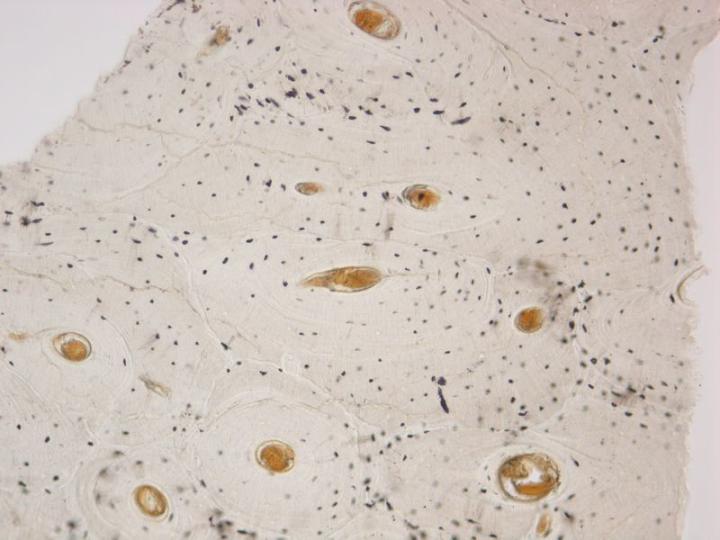
通常、骨や他の石灰化標本は、固定後に脱灰され、標準的な方法で処理されパラフィン切片が作製されます。脱灰された切片は、骨髄の検査や腫瘍・感染の診断のため、または、他の目的で用いられます。標本は、腸骨稜トレフィンまたは手術時に除去された骨片(大腿骨頭など)の形になっていてもよいし、切断標本から切り取ったものでかまいません。処理に適した骨標本の選択に役立てるために、詳細なX線像がよく用いられます。骨以外の他の組織でも、壊死(異栄養性石灰化)などの変性過程や、血管壁や腎臓、肺、その他の場所で石灰化する場合があります(転移性石灰化)。4 もし、組織標本中の石灰化領域が大きいと、最初に標本を脱灰しなければ、良い切片を得ることができない場合があります。別の可能性としては、標本処理の際にカルシウムの存在が予想されない場合に、「表面の脱灰」をパラフィンブロックに適用して、切片が得られるようにすることが考えられます。
この脱灰法は比較的簡単で、組織学的技術の標準的な教科書で詳細に考察されています。 1-3 しかし、もし、質の高い結果を得ようとするなら、強調しておく価値があるいくつかのポイントがあります。
骨の構造
骨は、1型 コラーゲン線維.を含む石灰化した基質に囲まれた細胞(骨細胞)から成ります。基質中には、カルシウムがハイドロキシアパタイト結晶 [Ca10(PO4)6(OH)2] の形で存在していて、これらは繊維成分の間に沈着しています。これらの結晶は、脱灰を正しく行った場合、密度の高い繊維質の結合組織の物理的特性を有する凝集性の組織を残して、脱灰の過程で溶け出します。
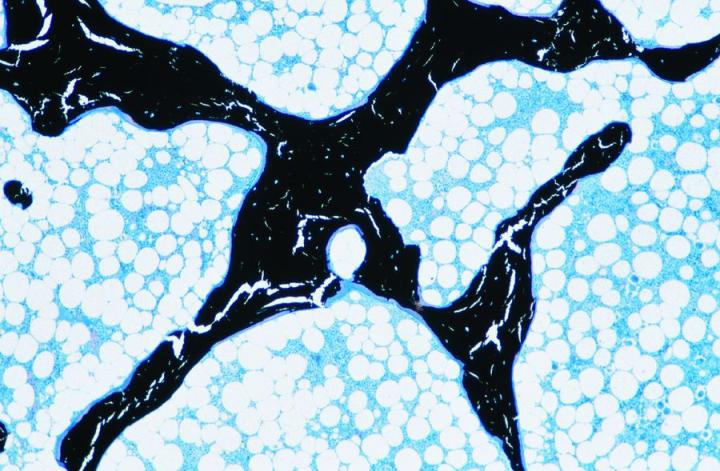
成熟した骨は2種類あります。皮質骨や緻密骨は、長骨の骨幹および頭蓋骨の扁平骨の主要部を形成していて、骨単位と呼ばれる円柱構造の配置を基盤にした、極めて密度の高い構造を持っています(図3)。海綿骨(cancellous bone, trabecular boneまたはspongy bone)は、さらに繊細に配置されていて、骨板を繋いでいる薄い区画(骨梁)より成っています。なお、骨板の間には骨髄があります。海綿骨は椎骨内、長骨の骨端に位置しています(図4)。緻密骨、海綿骨のいずれも、コラーゲン線維が構造的に配向された層または層板内で成長して、偏光顕微鏡下で特徴的な像を示します(図5参照)。2-3, 5
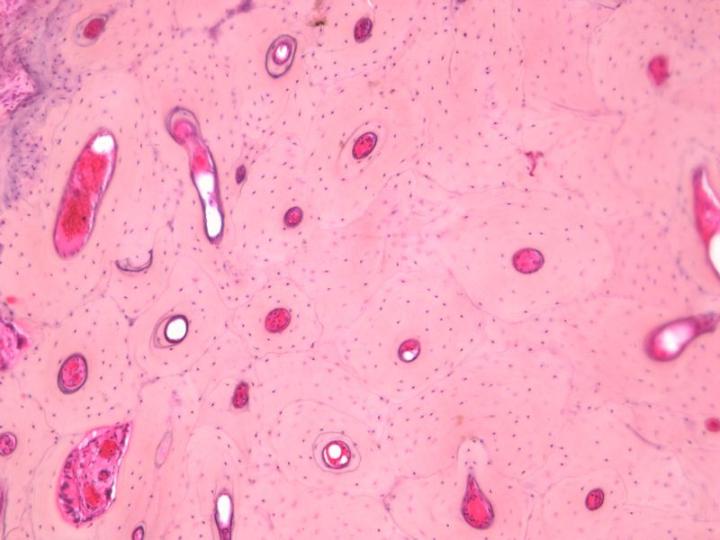
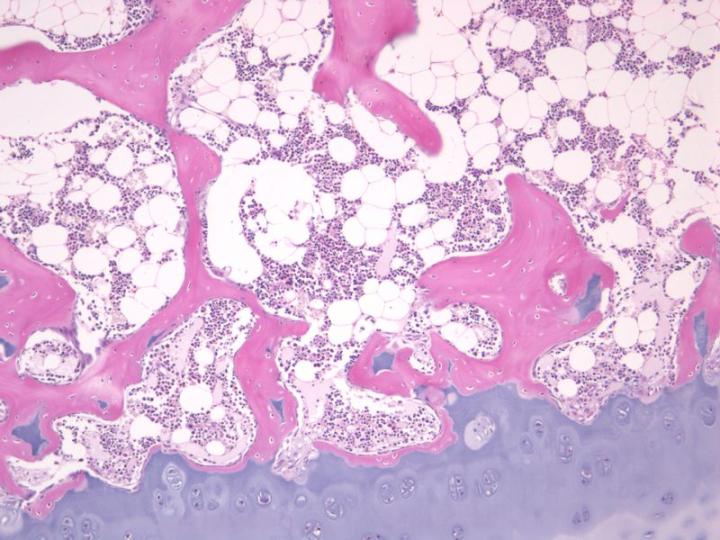

皮質骨や海綿骨の相対量は重要で、それにより脱灰や処理に必要な時間が決まるので、処理用に入手した骨標本の状態に注意を払うことが重要です。例えば、腸骨稜トレフィン標本は、海綿骨のシリンダーを覆っている皮質骨の周縁から成っています。皮質骨は、脱灰時にカルシウム塩を最後に放出するので、完全に脱灰されるまでは、良い切片を得ることは困難です。
骨の固定
脱灰試薬として用いる酸によるダメージから骨の細胞成分や繊維成分を保護するために、これらの標本を脱灰の前に完全に固定することが特に重要です。 2-3 固定が不十分な標本は、脱灰中に柔らかくなり、その後の染色が不十分になります。これは、骨髄を含む領域において極めて顕著に見られます。したがって、脱灰を開始する前に骨標本に関して固定時間を延長することが、検査室では一般的な方法になっています。骨に固定液が容易に浸透できるようにすることが重要で、したがって、可能であれば皮膚や軟組織を大きな標本から除去しなければなりません。骨標本は、固定を促進するためにできるだけ早く薄い切片にし、十分な量の固定液を加える必要があります。高品質のバンドソーを使用して骨をトリミングする必要があります。ノコギリの目が粗いと、かなりの物理的なダメージを与え、標本中に存在する軟組織へ骨の断片を押し込んでしまう可能性があります(図6参照)。
緩衝ホルマリン は骨に対する申し分のない固定液ですが、骨髄の保護が重要な場合は、検査室によっては、亜鉛ホルマリン混合物の1つ、B5、ホルマリン・酢酸・アルコール(Davidson 固定液)、ブアンなど、別の固定液を使用します。
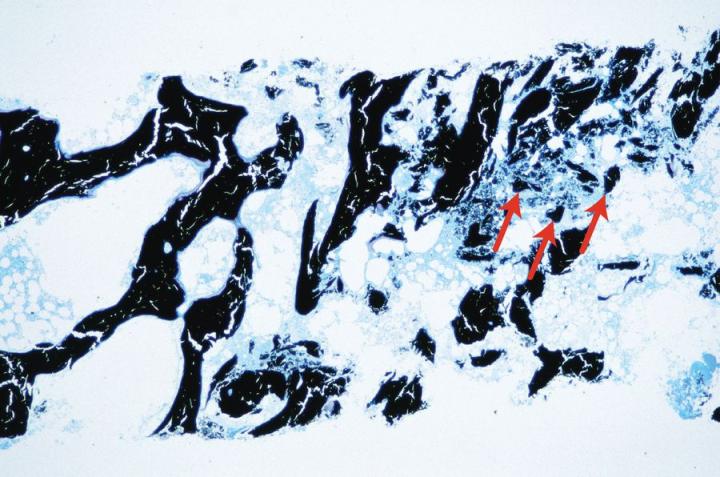
脱灰試薬 – 強酸
塩酸や硝酸のような強酸は、最高10%の濃度で、最も速く作用しますが、時間をかけ過ぎると、核染色がすぐに失われ、組織を柔らかくしてしまう可能性があります。適切なエンドポイントテストを用いて、これらの試薬への標本の曝露を最少にすることが重要です。一般に市販されている脱灰液で作用が速いとされているものは強酸ベースのもので、最も頻度が高いものは塩酸ですが、良好な結果を得るためには、提供されている使用説明書に従って注意深く控えめに使用しなければなりません。例えば、Surgipath’s Decalcifier II® は作用が速く、塩酸を含んでいます。図7は、鉱酸脱灰液を用いて、適切なエンドポイントを超えて長時間処理した結果を示しています。
表1は、数種類の一般的な鉱酸ベースの脱灰試薬のリストです。さらに包括的なリストについては、組織検査技術の標準的教科書を参照してください。
表1:鉱酸脱灰液
|
脱灰液 |
調合 |
コメント |
|
硝酸6 |
蒸留水中5% |
作用は速く、エンドポイントを超えると染色不良になります。 |
|
Perenyi’s fluid6 (1882) |
10%硝酸40 ml 0.5%クロム酸30 ml 無水アルコール30 ml |
硝酸溶液よりゆっくり脱灰する古典的な脱灰液。作用は極めて速く、エンドポイントを超えると染色不良になります。 |
|
塩酸 3 |
蒸留水中5~10% |
ビスクロロメチルエーテル(発がん物質)の形成を防ぐために、HClに入れる前に、標本からホルマリンを洗い落としておく必要があります。作用は速く、エンドポイントを超えると染色不良になります。 |
|
Von Ebner’s solution6 |
塩化ナトリウム飽和溶液50 ml 蒸留水42 ml 塩酸8 ml |
作用は速く、エンドポイントを超えると染色不良になります。 |
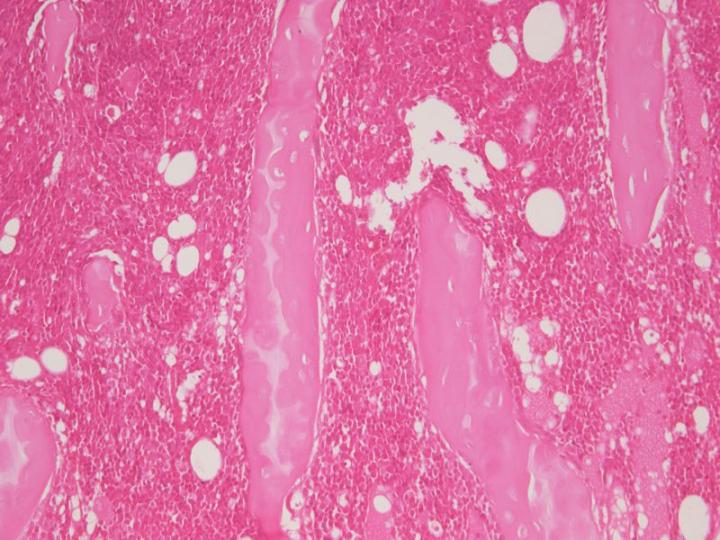
脱灰試薬 – 弱酸
ギ酸などの弱酸は使用されることが多く、脱灰に広く用いられています。ギ酸は単純な10%水溶液として、またはホルマリンや緩衝液と共に用いることができます。強酸の試薬より作用は遅いですが、より穏やかに作用し、核の染色を阻害する可能性は低くなっています。 1, 7 ギ酸をベースにした市販の脱灰液としては、Surgipath’s Decalcifier I®が挙げられます。この液はホルマリンを含有していて、固定に加え脱灰も行い、作用は穏やかであると説明されています。トリクロロ酢酸(TCA)など、他の酸も使用されてきました。ピクリン酸は、ある種の固定液の成分ですが、弱い脱灰特性を持っています。
表2:弱酸脱灰液
脱灰試薬 – キレート剤
エチレンジアミン四酢酸(EDTA)などのキレート剤は、アパタイト結晶の表面からカルシウムイオンを取り込むことにより機能し、結晶の大きさを徐々に小さくします。このプロセスは非常に遅いのですが、極めて穏やかなので(標本の大きさによっては数週間かかります)、この試薬は急を要する標本には適さず、研究用途に適しています。研究では、極めて高い品質の形態が要求されるか、 IHC、 FISH またはPCRのような技術に対して特定の分子成分が保存される必要があります。9 濃度約14%中和溶液として用いられます。1,10 EDTAが脱灰する速度は、pHに依存します。通常はpH7.0で使用します。pH10で迅速に作用しますが、いくつかの組織成分がアルカリpHでダメージを受ける可能性があります。 10
表3:キレート試薬
|
脱灰液 |
調合 |
コメント |
|
中性EDTA1 |
EDTA二ナトリウム塩250 g 蒸留水1750 ml 水酸化ナトリウムを加えてpH 7.0にします(約25 gが必要)。 |
ゆっくり作用しますが組織にほとんどダメージを与えません。通常の染色はほとんど影響を与えません。 |
脱灰率に影響を及ぼす要素
濃度
活性剤の濃度はカルシウム除去速度に影響します。公表されている脱灰液の製法は、組織ダメージの速さと程度とをうまく両立させています。覚えておかなければならないのは、活性剤の濃度はカルシウムと結合すると減少することです。したがって、大量の脱灰液を用い、脱灰の過程で数回補給することが賢明です。
温度
温度を上昇させるとその分、脱灰率が進みますが、組織への損傷率が高まるため、十分な注意が必要です。
撹拌
穏やかに攪拌すると速度が少し上昇します。1
液体の到達
固定と同様に、新鮮な脱灰液は標本表面全体に容易に到達できなければなりません。これにより、標本への拡散と浸透が促進され、溶解、イオン化、カルシウムの除去を容易にします。
脱灰効率を増加させる他の技術
EDTAと共に超音波処理を用いて、後の分子解析のために、トレフィン標本の脱灰を速めることに成功しました。この過程の間、温度を注意深く制御しなければなりません。9マイクロ波処理を塩酸脱灰液と共に使用しましたが、上昇した温度により形態がダメージを受け、染色のアーチファクトが生じた可能性があります。10 イオン交換樹脂はいくつかの脱灰プロトコールで使われています。イオン交換樹脂は、脱灰液が入っている容器に加えられ、酸の有効性を維持しながらイオン化カルシウムを吸収します。酸性脱灰液が適切な量で使用され、定期的に交換される場合は、そのような樹脂の使用はおそらく不要です3骨を酸性脱灰液に入れ、電極に取り付けて電流を流す電解脱灰は、標本に熱損傷を引き起こす可能性があるため、広く受け入れられていない技術だと認められます。3
脱灰のエンドポイントの決定
高品質の結果を得るためには、すべてのカルシウムが除去された時点を特定することが重要です。というのは、この時点以降、組織の損傷が加速すると考えられるからです。特に強酸脱灰液による過剰脱灰は、細胞核などの好塩基性要素の染色が損なわれ、状況によっては、軟組織成分の浸軟を引き起こす可能性があります。一方、脱灰が不完全な標本は、切片にすることが難しいか不可能です。
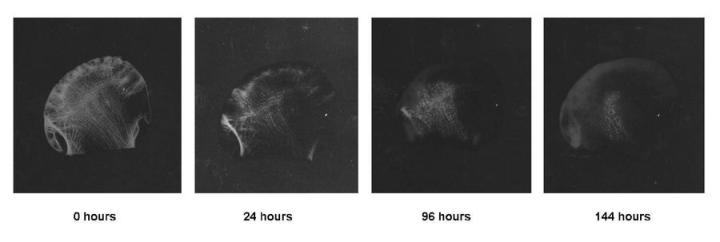
特に大腿骨頭などの大きな標本を使用する場合の最良の方法は、X線で標本を検査することです。良質のX線は、小さな残留するカルシウム沈着をはっきりと示し、必要な場合はさらなる処理が可能です。これは、大腿骨頭などの大きな標本の脱灰プロセスを追跡するための優れた方法です(図8参照)。一部の酸性脱灰液(特にギ酸)を使用する場合は、簡単な化学的検査を適用することができます。水酸化アンモニウムで中和した脱灰液で脱灰の最終段階と思われるサンプルに、シュウ酸アンモニウム溶液を追加します。1 カルシウムが存在すると、シュウ酸カルシウムが沈殿し、脱灰がおそらく不完全であると分かります。そして、脱灰にはより長い時間が必要になります。もちろん、この検査は、比較的最近交換した脱灰液で(組織への曝露が、たとえば1時間だけ)で行うのが最善です。 物理的検査 では、残っている石灰化領域を「感知する」ために、標本を曲げたり、プローブで探査したり、トリミングしたりする操作が必要です。この方法は熟練者ではうまくいく場合もありますが、一般的には信頼性が低いと考えられています。曲げたり、プローブで探索したりしている時に中に、物理的なダメージが生じる可能性があり、カルシウムの小さな沈着が簡単に見逃される可能性があります。7水洗いし水を吸い取った後に標本を注意深く秤量することによりエンドポイントを決定する方法も説明されています。これは大きな標本に対して効果的な方法かもしれません。10
石灰化のエンドポイントが近いと考えられるので、脱灰が過剰になりその結果組織が損傷するのを防ぐためにプロセスの進行を遅くしたい場合、例えば週末に研究室が無人になるような場合ですが、このような場合は、標本を脱灰液から取り出してすすぎ、ホルマリンに戻すことができます(塩酸を使用している場合は重要)。その後、都合の良いときに脱灰を再開することが可能です。10 別の方法としては、標本を脱灰液中4°Cで冷蔵することで、このプロセスを減速させます。1

脱灰後および処理前の処置
処理前に残留する酸性脱灰液を中和するためのさまざまな方法が公表されており、水道水による徹底的な洗浄やアルカリ溶液の利用などがあります。処理中に残留する酸はすべて除去されるため、通常は水道水での短時間の効果的な洗浄で十分です。1 大部分の脱灰液を除去して、処理試薬と処理装置を酸で汚染しないようにすることが重要です。
脱灰骨や他の脱灰組織に適したスケジュールの選択
ミネラル分を除去後、標準処理スケジュールを使用します。完全に脱灰しても、骨、特に緻密骨には、濃度の高い部分があるため、完全な処理が必要であることに留意しておかなければなりません。短すぎるよりも長すぎるスケジュールを使用するほうがよいでしょう。どちらを選択するかは、標本の性質と大きさによります。パラフィン浸透中に真空を適用すると、完成したブロックの品質が向上します。
表層脱灰
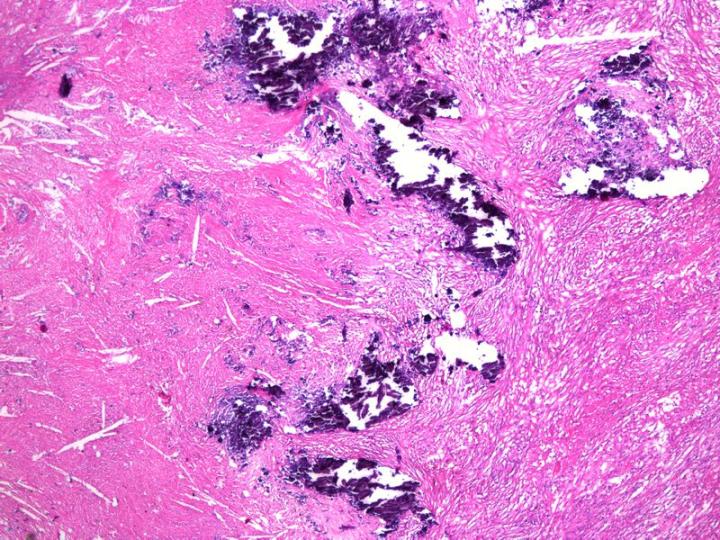
これは、パラフィンブロックで遭遇することがある、小さな予期せぬカルシウムの沈着物に対処する方法です。(図10参照)。通常、カルシウムが発見されるのは、標本を露出させるためにミクロトームでブロックをトリミングした後です。この段階でブロック表面を広範囲に破壊しないようにすることが重要です。組織が露出した後、ブロックをミクロトームから取り外し、下向きにして酸性脱灰液中に15〜60分間置きます。この表面処理により、脱灰液がブロック内の浅い距離に浸透し、カルシウムを溶解します。その後、このブロックを水で完全に洗浄し、残留酸を除去して切片作製を行います。脱灰液は非常に短い距離しかブロックに浸透せず、ほんの2~3枚の切片しかとることができないので、ブロックは慎重に再調整する必要があります。1, 11
結論
結論
脱灰は簡単なプロセスですが、成功するためには以下が必要です:
- 標本の慎重な予備評価
- 完全な固定
- 固定と処理に適した厚さのスライスの準備
- 適切な量の適切な脱灰液の選択、定期的な変更
- エンドポイントの慎重な決定
- 適切なスケジュールを使用した完全な処理
この記事の原文は こちら
About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
References
- Page KM. Bone. In Bancroft JD and Stevens A eds. Theory and Practice of Histological Techniques. New York: Churchill Livingstone, 1996.
- Moore RJ. Bone. In Woods AE and Ellis RC eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;7.2-10.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 2007.
- Vardaxis NJ. Pathology for the health sciences. Melbourne: Macmillan Australia Pty Ltd, 1997.
- Young B, Heath JW. Wheater's Functional Histology. 4th ed. Edinburgh: Churchill Livingstone, 2000.
- Clayden EC. Practical section cutting and staining. Edinburgh: Churchill Livingstone, 1971.
- Skinner RA, Hickmon SG, Lumpkin CK, Aronson J, Nicholas RW. Decalcified Bone: Twenty Years of Successful Specimen Management. The Journal of Histotechnology 1997;20;267-277.
- Wallington EA. Histological Methods for Bone. London: Butterworths, 1972.
- Reineke T, Jenni B, Abdou MT et al. Ultrasonic Decalcification Offers New Perspectives for Rapid FISH , DNA, and RT_PCR Ananlysis in Bone Marrow Trephines Am J Surgical Pathology 2006;30.
- Callis G, Sterchi D. Decalcification of Bone: Literature Review and Practical Study of Various Decalcifying Agents, Methods, and Their Effects on Bone Histology. The Journal of Histotechnology 1998;21;49-58.
- Rolls GO. Difficult Blocks and Reprocessing. Leica Microsystems, 2011.
Related Content
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.