
Eine Einführung in Routine‑ und Spezialfärbungen


Routinefärbungen, allen voran die H&E-Färbung, und Spezialfärbungen spielen in der gewebebasierten Diagnostik und Forschung eine bedeutende Rolle. Durch die selektive Färbung ansonsten transparenter Strukturen ermöglichen sie die Betrachtung und Beurteilung unterschiedlichster Zellen und Gewebe. Qualifizierte Pathologen und Forscher bewerten die morphologischen Eigenschaften dieser Elemente, aus denen sie funktionelle Charakteristika ableiten und auf denen viele Klassifizierungen beruhen, und erkennen auch Störfaktoren wie Pathogene.
Im histopathologischen Labor bezieht sich der Begriff „Routinefärbung“ in aller Regel auf die Hämatoxylin-Eosin-Färbung, kurz H&E. Es ist eben diese Färbung, die routinemäßig auf nahezu alle Gewebeproben angewendet wird, um grundlegende Erkenntnisse zu deren Struktur zu erlangen. Von Spezialfärbungen hingegen ist die Rede, wenn alternative Färbemethoden erforderlich werden, weil die H&E-Färbung nicht alle Informationen liefert, die der Pathologe oder Forscher braucht. Dabei umfasst der Begriff eine große Anzahl verschiedener Färbetechniken.
Vorbereitung von Gewebe für die Färbung
Bevor Gewebe gefärbt und betrachtet werden kann, muss es so vorbereitet werden, dass ein sehr dünner Schnitt angefertigt werden kann, der nur so dick wie eine einzige Zelle ist und auf einen Objektträger aufgezogen wird. Diese Vorbereitung umfasst die Fixierung des Gewebes, damit es nicht zerfällt, und seine Härtung, um die eben beschriebenen, hauchdünnen Präparate schneiden zu können. Typischerweise sind die etwa 2-7 µm stark. Zwei Techniken sind hierbei besonders hervorzuheben: die Gefrierschnitterstellung und die Anfertigung von Schnitten aus in Paraffin eingebetteten Gewebeproben.
Gefrierschnitte werden dann bevorzugt, wenn sofort Antworten benötigt werden, typischerweise während einer Operation, bei der der Chirurg den Exzisionsrand für die Entfernung eines Tumors bestimmen muss. Sie können besonders schnell erzeugt werden, sind den Paraffinschnitten aber meist qualitativ unterlegen. Ein Gefrierschnitt wird wie folgt erstellt:
- Das Gewebe wird in kürzester Zeit eingefroren, um es zu konservieren und zu härten.
- Das gefrorene Gewebe wird in einem Kryostaten, also einem Schnittmikrotom in einer Gefrierkammer, geschnitten und zum Färben auf einen Objektträger aufgezogen.
- Der Schnitt wird fixiert, um Abbauprozesse einzuschränken, und anschließend gefärbt.
Bei Paraffinschnitten wird die Probe zunächst mit einem Fixiermittel konserviert und anschließend mit Paraffinwachs infiltriert, um die Gewebestruktur zu stützen. Der Prozess ist zeitaufwendiger als die Erstellung von Gefrierschnitten, liefert jedoch in den meisten Fällen das bessere Färbeergebnis und die resultierenden Paraffinblöcke, in denen das Gewebe steckt, können fast unbegrenzt aufbewahrt werden. Die Paraffinschnitterstellung umfasst folgende Schritte:
- Die Fixierung konserviert das Gewebe und erfolgt meistens in einer Lösung auf Formaldehydbasis.
- Beim groben Zuschneiden wird der untersuchungsrelevante Gewebebereich von weniger interessanten Abschnitten befreit.
- Während der Gewebeverarbeitung und -infiltration kommt eine Reihe von Reagenzien zum Einsatz, mit deren Hilfe das zunächst wässrige Gewebemilieu durch ein hydrophobes ersetzt wird, was die Probe mit Paraffinwachs infiltrierbar macht.
- Die Einbettung ermöglicht die Ausrichtung der Probe und ihre feste Positionierung in einem Wachsblock, aus dem Schnitte angefertigt werden und der dann aufbewahrt werden kann.
- Die Schnitterstellung erfolgt auf einem Mikrotom, das hauchdünne Gewebescheiben von der eingebetteten Probe schneidet, die man in einem Wasserbad aufschwimmen lässt und von hier auf Objektträger mit.
- Die Objektträger mit den frisch aufgezogenen Schnitten werden in einem Ofen oder auf einer Heizplatte getrocknet, um Feuchtigkeit zu entfernen und die Haftung des Gewebes am Objektträger zu unterstützen.
- Das Gewebe auf dem Objektträger ist nun bereit zum Färben.
- Der erste Färbeschritt ist das Entwachsen, wobei ein Lösungsmittel verwendet wird, um vor der eigentlichen Färbung das Wachs aus dem Gewebe zu entfernen. Paraffinschnitte werden im Rahmen des Färbeprozesses grundsätzlich entwachst. Wenn die Färbung abgeschlossen ist, wird der Schnitt mit einem Deckglas abgedeckt und so für seine weitere Handhabung geschützt.

Warum die H&E-Färbung routinemäßig Anwendung findet
Die H&E-Färbung wird in histopathologischen Labors routinemäßig durchgeführt, da sie dem Pathologen bzw. Forscher eine sehr detaillierte Darstellung des Gewebes ermöglicht. Diese detaillierte Darstellung beruht auf einer klaren und deutlichen Anfärbung von extra- und intrazellulären Elementen einschließlich des Zytoplasmas, des Zellkerns und der Organellen. Die daraus abzuleitenden Informationen reichen oft aus, um eine Diagnose zu stellen, insbesondere wenn diese auf der räumlichen Organisation (oder Desorganisation) der Zellen beruht oder auf Anomalien, die in der H&E-Färbung gut erkennbar sind, z. B. bei pathologischen Veränderungen im Nukleus von Krebszellen. Trotz aller Fortschritte in den Färbetechniken ist die H&E-Färbung nach wie vor das Fundament der histopathologischen Diagnostik. Tatsächlich werden aufwendigere, weniger häufig angewendete Färbungen oft im Zusammenhang mit der H&E-Färbung interpretiert.
Im klinischen Labor werden deshalb nahezu alle Proben zunächst mit H&E gefärbt und Spezialfärbungen werden nur dann in Auftrag gegeben, wenn zusätzliche Informationen benötigt werden, um eine detailliertere Analyse zu liefern. Das ist etwa dann der Fall, wenn zwei morphologisch ähnliche Krebsarten unterschieden werden sollen.
Aufgrund des hohen Durchsatzes von H&E-Färbungen setzen die meisten Labore auf vollautomatische Systeme, um diese Aufgabe zu stemmen. Manuelle H&E-Färbungen sieht man nur noch selten.
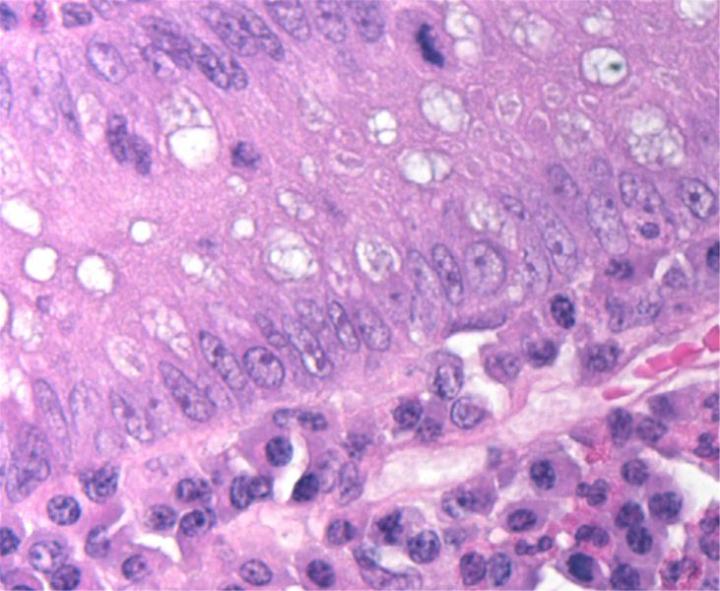
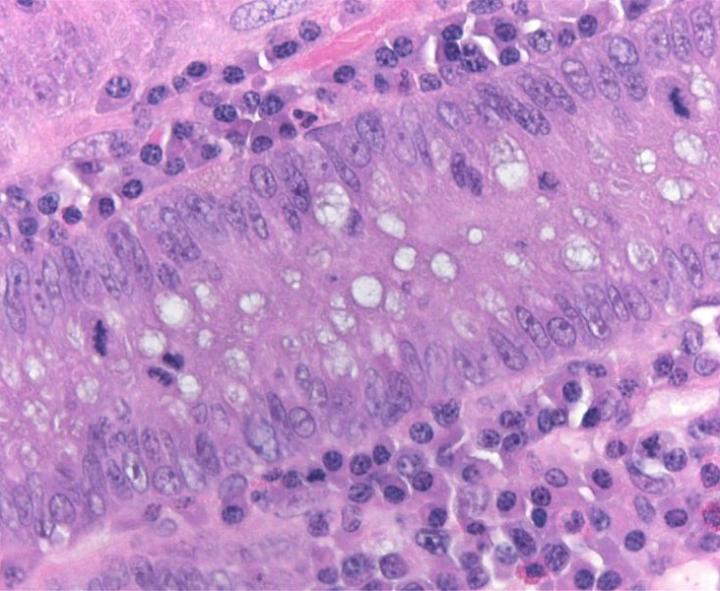
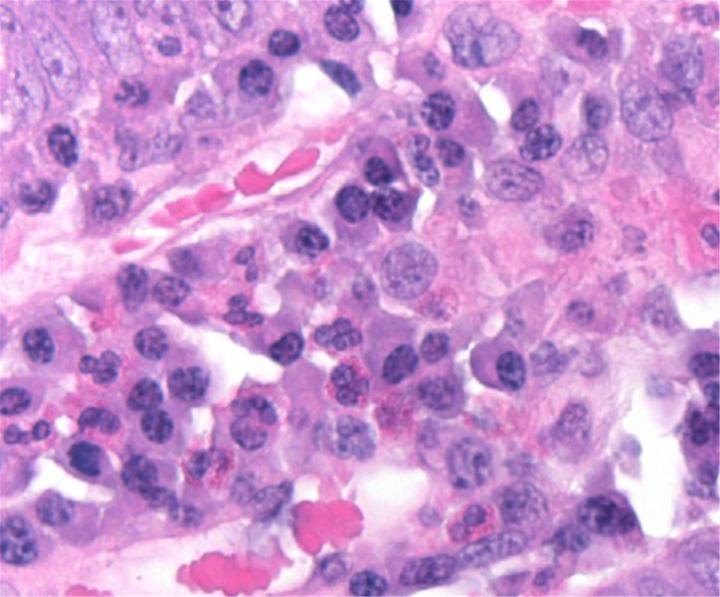
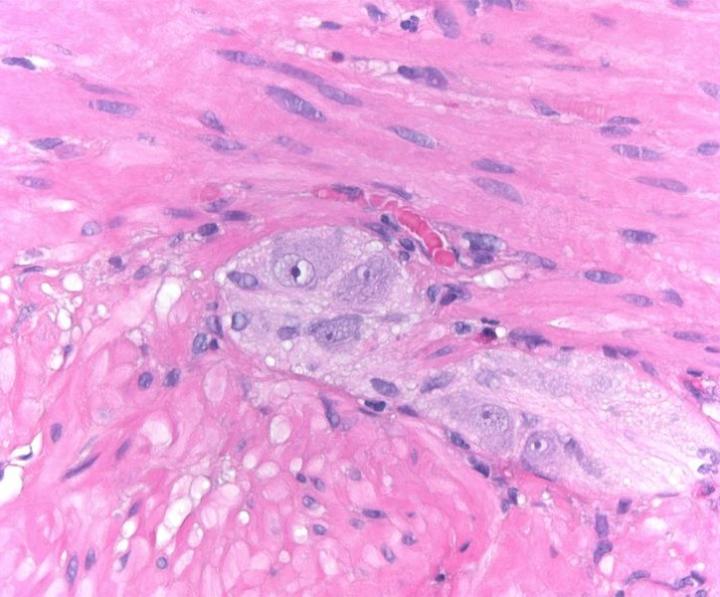
Chemische Grundlagen der H&E-Färbung
Die H&E-Färbung umfasst den Einsatz zweier Farbstoffe: Hämatoxylin und Eosin. Diese Kombination empfiehlt sich, weil sich die beiden Farbstoffe in ihrer Affinität zu den einzelnen Gewebeelementen unterscheiden und deshalb verschiedene Strukturen anfärben.
Hämatoxylin ist ein basischer Farbstoff von blau-violetter Farbe. Es färbt saure (basophile) Strukturen an, einschließlich des Zellkerns mit seiner DNA und den Nukleoproteinen sowie Organellen, die RNA enthalten, darunter die Ribosomen und das raue endoplasmatische Retikulum.
Eosin hingegen ist ein saurer Farbstoff, der typischerweise rötlich oder rosa erscheint. Eosin bindet an basische (azidophile) Strukturen wie das Zytoplasma, die Zellwand und extrazelluläre Fasern.
Herkunft der Farbstoffe
Hämatoxylin wird aus dem Blutholzbaum extrahiert und dann aufgereinigt. Anschließend wird es oxidiert und mit einem Beizmittel versetzt, meist mit Aluminium, um seine Kapazität zur Bindung an Zellstrukturen zu erhöhen. Heute stehen zahlreiche Hämatoxylinzubereitungen zur Verfügung, von denen Gills Hämatoxylin, Harris Hämatoxylin und Mayers Hämatoxylin am häufigsten genutzt werden.
Eosin geht aus einer Reaktion zwischen Brom und Fluorescein hervor. Es gibt zwei Varianten dieses Farbstoffs, die regelmäßig in der Histologie verwendet werden: Eosin Y, das leicht gelblich ist, und Eosin B, dessen Farbe ins Bläuliche tendiert. Eosin Y ist das meistgebrauchte Eosin.
Spezialfärbungen
Der Begriff Spezialfärbung wird traditionell für alle Färbungen außer der H&E-Färbung verwendet. Damit umfasst er eine Vielzahl von Methoden, die Anwendung finden, um bestimmte Strukturen, Gewebekomponenten oder sogar Mikroorganismen darzustellen, die in einer H&E-Färbung nicht sichtbar sind.
Andere Färbemethoden wie die Immunhistochemie und In-situ-Hybridisierung zielen auf die Detektion und Visualisierung spezifischer Proteine bzw. DNA- und RNA-Sequenzen ab. Mitunter rechnet man sie der großen Gruppe der Spezialfärbungen zu. Allerdings unterscheiden sie sich in Methode und Zweck erheblich von den klassischen Spezialfärbungen, weshalb sie vielerorts separat behandelt werden, und zwar als „moderne Färbungen“ oder unter dem englischen Begriff „Advanced Staining“.
Während es buchstäblich Hunderte von Spezialfärbungen zu allen möglichen Zwecken gibt, haben für die klinische Histologie nur wenige eine größere Bedeutung. Diese Vielfalt bedeutet auch, dass die Automatisierung im Bereich der Spezialfärbungen weniger stark vorangeschritten ist als bei der routinemäßigen H&E-Färbung. Während viele größere Labore Färbeautomaten besitzen, die die häufigeren Färbungen automatisch durchführen, haben sie alle noch einen Bereich für die manuelle Färbung. Darüber hinaus sind einige Färbungen derart komplex, dass sie sich kaum automatisieren lassen.
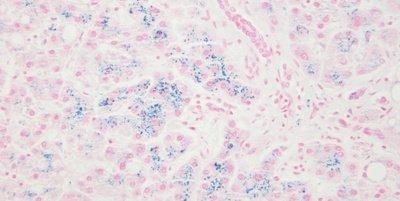
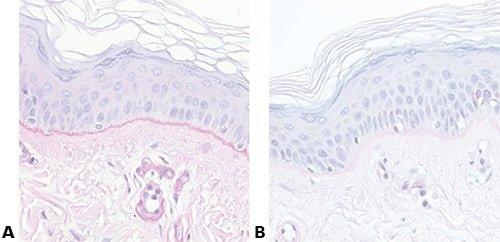
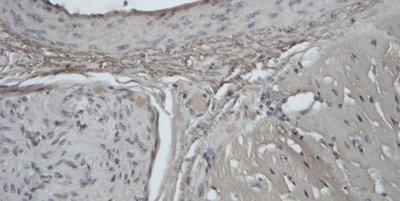
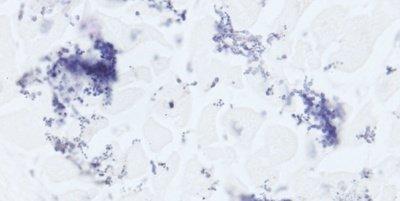
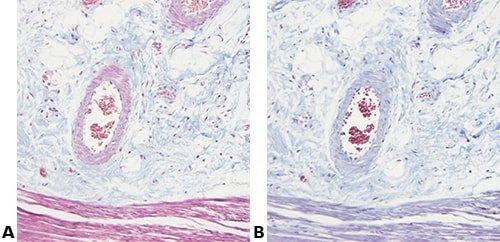
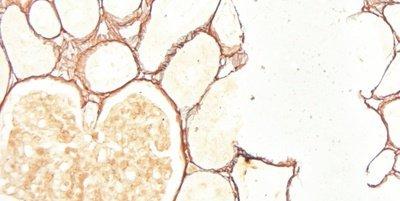
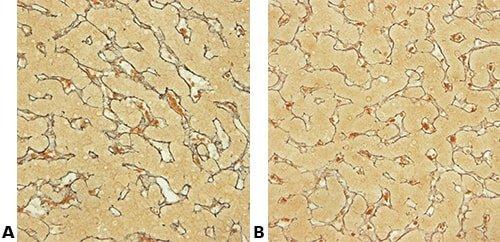
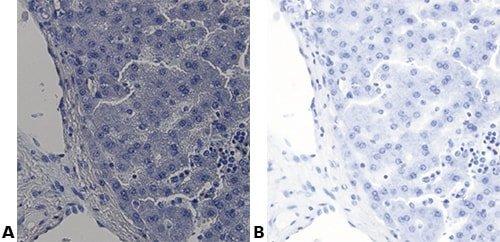
Einige wichtige Spezialfärbungen
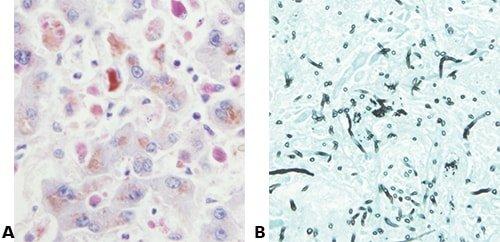
Die nachstehenden Bilder veranschaulichen die Wirkungen der häufigsten Spezialfärbungen und zeigen Beispiele für deren Anwendungsgebiete.
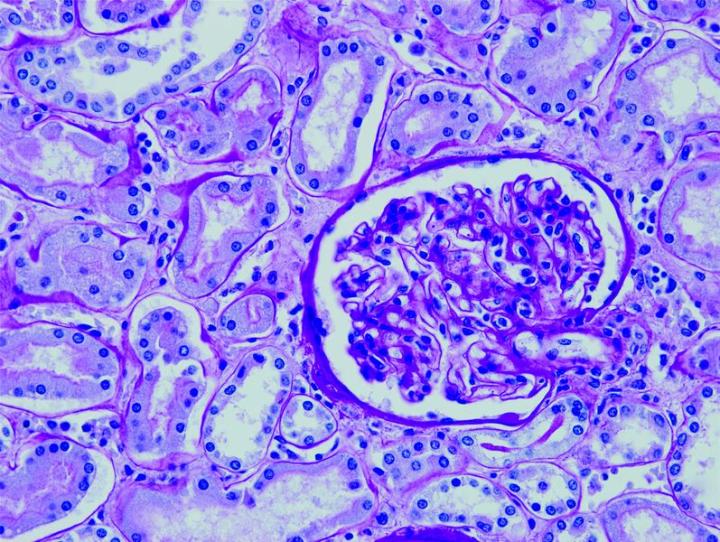
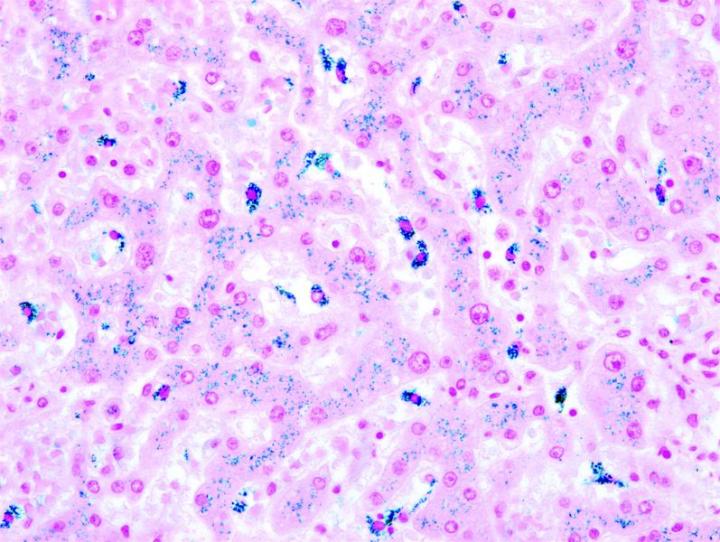
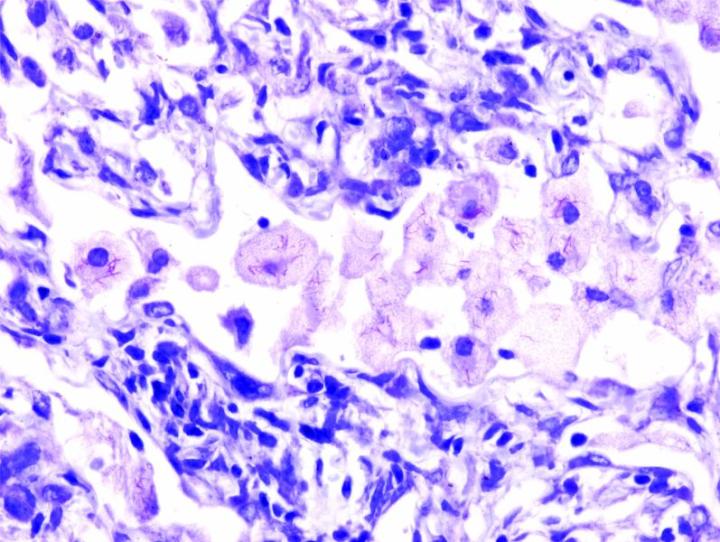
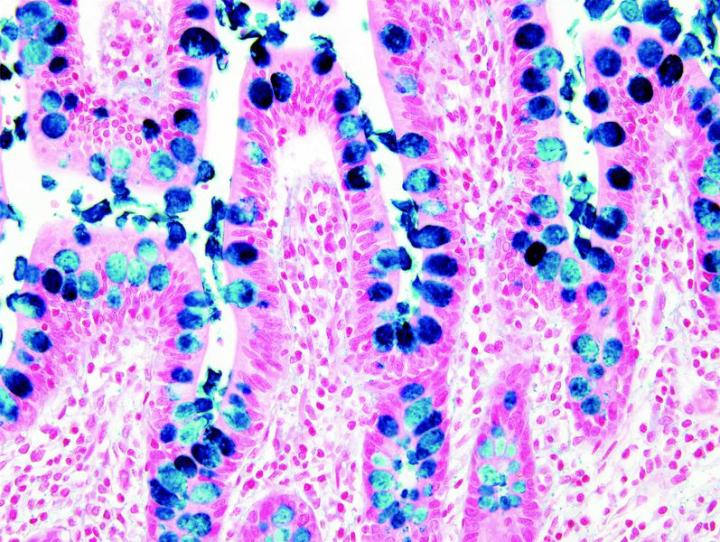
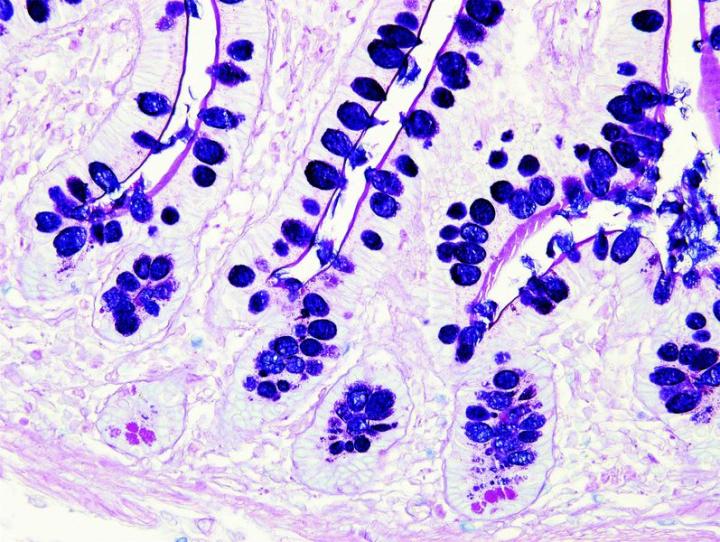
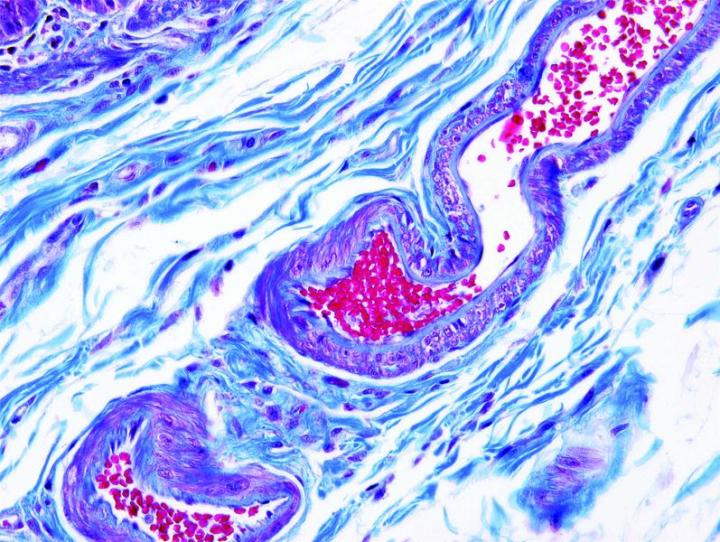
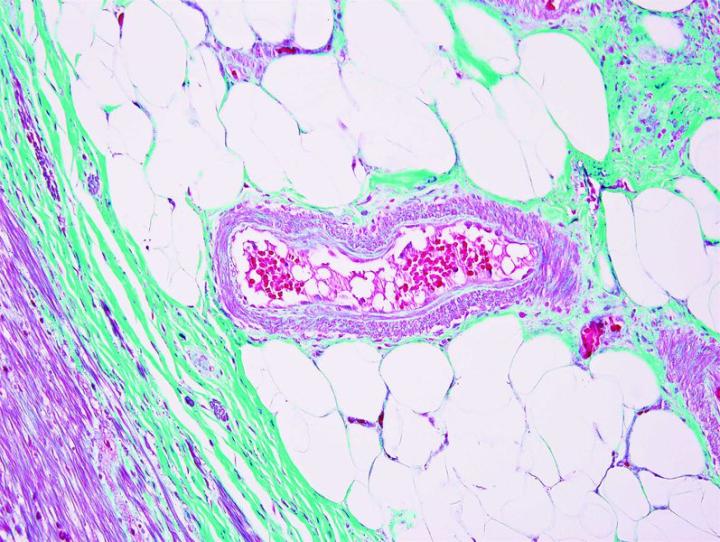
Schritte zu besseren Spezialfärbungen
Leica Biosystems versteht es als seine Mission, eine bessere Krebsdiagnostik und damit höhere Lebensqualität zu ermöglichen. Eine Möglichkeit zur Umsetzung dieser Mission ist die Verbesserung der Färbequalität. Wir wissen, dass die Qualität von IHC- und ISH-Färbungen nicht allein vom Färbemittel abhängt, und wollen in dieser Serie auf die unterschiedlichen Faktoren schauen, die die Färbequalität beeinflussen. Wir hoffen, damit einen Beitrag zu höherer Diagnosesicherheit zu leisten.
Die Färbung verstehen
Sie wissen, was Sie mit der Färbung, die Sie durchführen, zu zeigen versuchen.
Einem Protokoll zu folgen, ohne zu wissen, was im Schnitt zu sehen sein soll, führt selten zum Erfolg.
Immer eine Positivkontrolle mitführen
In jedem Durchlauf wird eine Positivkontrolle mitgeführt, also ein Präparat, das sicher die Zielstrukturen enthält, die Sie zeigen bzw. anfärben möchten.
Wenn die Zielstruktur nicht dargestellt werden kann, wird angenommen, dass sie im Präparat nicht enthalten ist.
Zeitliche Vorgaben einhalten
Man hält sich an die zeitlichen Vorgaben im Protokoll.
Zeitliche Vorgaben werden nur ungefähr eingehalten. Ein solches Vorgehen führt zu ungefähren, d. h. inkonsistenten, nicht reproduzierbaren Ergebnissen.
Stabilität der Reagenzien berücksichtigen
Man achtet auf die Haltbarkeit der Reagenzien, die verwendet werden sollen. Einige Reagenzien oder Farbstofflösungen zersetzen sich langsam, während andere sehr instabil sind, frisch angesetzt und sofort verwendet werden müssen. Wieder andere können erst mit einer gewissen Verzögerung benutzt werden, weil beispielsweise Oxidationsprozesse ablaufen müssen, bevor die Lösung einsatzbereit ist.
Man geht davon aus, dass sämtliche Reagenzien auf unbestimmte Zeit verwendet werden können.
Reagenzien ordnungsgemäß lagern
Sämtliche Reagenzien werden gemäß den Herstellerempfehlungen gelagert. Einige bedürfen einer dauerhaften Kühlung, weil sie sonst allzu leicht schimmeln oder andere Mikroorganismen in ihnen wachsen. Andere sind lichtempfindlich und müssen im Dunkeln gelagert werden.
Alle Reagenzien stehen griffbereit im Regal über der Färbebank. Nicht selten verderben sie dort.
Dem Protokoll folgen
Man folgt dem Protokoll in allen seinen Schritten.
Mitarbeiter erzielen unterschiedliche Ergebnisse, obwohl sie vermeintlich dem gleichen Protokoll folgen.
Abweichungen notieren
Jede Abweichung vom Protokoll wird unverzüglich festgehalten.
Wenn die Ergebnisse nicht den Erwartungen entsprechen, ist es manchmal schwierig oder gar unmöglich, herauszufinden, woran es gelegen haben könnte, weil Änderungen am Protokoll nicht konsequent notiert wurden.
Waschschritte standardisieren
Auch was die Waschschritte betrifft, hält man sich streng ans Protokoll. Bekanntermaßen sind sie eine häufige Ursache von unerwünschter Variabilität in den Ergebnissen, weshalb sie standardisiert werden müssen.
Man wendet unterschiedliche Waschtechniken an: Manche Mitarbeiter schütteln kräftig, andere schwenken sanft. Und dazwischen bleibt viel Platz für Variationen.
Mikroskop für Qualitätskontrolle einstellen
Entscheidende Zwischenschritte, z. B. solche, die einer Differenzierung bedürfen, werden mikroskopisch kontrolliert. Dabei weiß der Anwender, wie sich die routinemäßigen Einstellungen des Mikroskops auf das Erscheinungsbild von nassen, noch nicht eingedeckten Schnitten auswirken. Ihm ist bewusst, wie er das Gerät einstellen muss, um nicht dem falschen Eindruck einer Hintergrundfärbung zu erliegen.
Der Grad der Färbung wird allein durch die Betrachtung des Objektträgers mit bloßem Auge beurteilt.
About the presenters

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.