
관절 연골 접힘 최소화 기법
저희 부서는 뼈 조직학뿐만 아니라, 관절 연골 연구에도 관심이 있습니다. 관절 연골을 평가할 때, 정상적인 마모 또는 외과 모델로 인해 발생한 표면 손상이 있는지 확인합니다. 관절이 탈회된 후, 관절 연골 내 프로테오글리칸 소실로 인해 염색 과정 동안 관절 연골이 접히고 주름이 생깁니다. 이 경우, 연골의 조직형태계측 또는 측정이 불가능해집니다. 이 논문에서는 관절 연골 접힘을 줄이거나 없애는 데 도움이 되는 몇 가지 팁을 설명할 것입니다.
육안표본제작/고정
해부로부터 봉입까지 조직학 과정의 모든 단계는 중요하고, 관절 연골 검체에서 특히나 중요합니다. 검체를 적절히 해부하는 것은 매우 중요합니다. 예를 들어, 마우스 뒷다리를 잘 해부하여 연조직과 결합조직을 가능한 한 적게 남겨두어야 합니다. 관절 주위 육안 표본을 제작할 때, 관절을 보호하기 위해 조직을 그대로 남겨둡니다(그림 1). 검체의 육안 표본을 제대로 제작하지 않거나 수화 상태를 유지하지 않는 경우, 석회질 제거와 처리가 제대로 이루어지지 않아 결과가 좋지 않을 것입니다. 뼈 검체는 10% 중성 완충 포르말린에 최소 72시간 동안 고정해야 합니다. 그 후, 검체를 잘 헹구어 고정에서 염을 제거한 후, 검체와 그 크기에 따라 7~14일 동안 EDTA와 같은 탈회제에 넣습니다. 탈회제는 신선해야 하고 정기적으로 교체해야 합니다. x-레이, 옥살산암모늄을 사용한 화학 검사1 또는 중량 검사와 같은 탈회 종말점 검사를 사용하는 것이 중요합니다2. 뼈에서 모든 칼슘을 제거하는 것이 중요하며, 검체를 탈회 용액에 너무 오래 남겨두지 않는 것도 똑같이 중요합니다. 검체를 탈회제에 너무 오래 남겨두면 프로테오글리칸이 과도하게 소실되어 절편 접힘 확률이 증가합니다.

처리
뼈 처리 프로그램은 자동화 처리기에서 스테이션당 일반적으로 1시간씩 긴 처리 주기를 필요로 합니다. 토끼, 개와 같은 보다 큰 검체는 보다 긴 프로그램을 필요로 합니다. 국립조직검사학학회 수의학, 산업 및 연구 위원회(National Society for Histotechnology, Veterinary, Industry and Research Committee)의 동물 처리 설명서는 모든 유형의 조직 처리에 유용한 참고 자료입니다3. 보다 높은 농도의 플라스틱 폴리머를 포함하는 파라핀(Paraplast Plus)이 뼈 조직을 보다 효과적으로 침투하기에, 처리 시 이를 사용합니다. 조직은 처리 전 완전히 고정해야 합니다. 바람직한 검체 두께는 3~4 mm 또는 대략 1센트 두께입니다. 검체가 너무 커 카세트에 ""밀어 넣은"" 경우, 시약이 조직을 탈수, 투명 또는 침투할 수 없을 것입니다.
포매
파라핀 포매는 모든 다른 검체와 마찬가지로 뼈와 관절 검체로 작업할 때 조직학 과정에서 중요한 단계입니다. 검체 방향 결정은 매우 중요합니다. 뼈를 비스듬히 포매하는 경우, 뼈가 부러지고 블록이 “덩어리로 잘릴” 수 있습니다. 보다 단단한 파라핀(Paraplast)은 뼈를 보다 쉽게 절단할 수 있게 하며, 보다 많은 지지와 안정성을 제공합니다. 가능한 한 평평하게 조직을 포매합니다. 절단면이 있는 경우, 몰드에 절단면이 아래를 향하도록 포매합니다. 골격근에 초점을 맞추고 있기에, 마우스 다리, 대퇴골, 경골을 경골/비골 결합부가 위를 향하게 “스마일” 방향으로 포매합니다(그림 2).
검경 절편 제작법
모든 유형의 뼈 검체를 절단할 때 초강력 마이크로톰이 있는지 확인합니다. 블록을 다듬거나 안쪽으로 작업할 때 매우 조심하십시오! 필요한 경우, 천천히 다듬고 블레이드를 교체합니다. 너무 빨리 다듬으면 뼈 또는 관절이 덩어리로 잘릴 수 있습니다. 블록을 얇은 얼음 면이 있는 얼음 트레이에 올려 놓고, 절단 전 블록을 적십니다. 블록이 차가울수록 뼈를 쉽게 절단할 수 있습니다. 블록이 차가울 때 파라핀이 더 강해져 보다 많은 지지를 제공합니다. 절단할 때 검체에 칼슘이 남아 있는 경우, 검체가 덩어리로 잘리거나 절편이 슬라이드에서 들어올려져 관절 연골이 접힐 가능성이 증가할 수 있습니다. 뼈와 관절은 슬라이드에 부착하기 어렵습니다. 슬라이드 선택을 심사숙고해야 하고, 보다 충전된(charged) 슬라이드가 접힘과 주름 발생 확률을 줄여줄 것입니다. 뼈는 포매하기 어려울 수 있기에, 척/블록 홀더의 각도를 조정하여 적절한 레벨 또는 평면에 도달해야 합니다. 인내심을 가지십시오!
염색
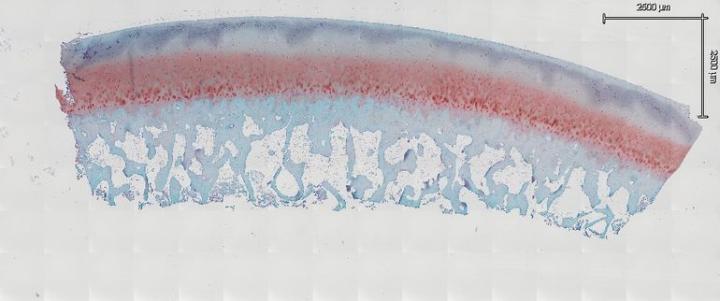
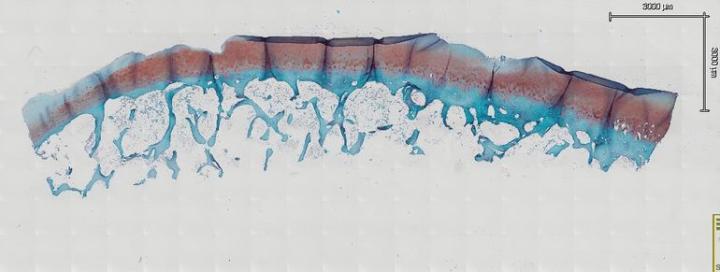
일상적인 또는 특수 염색을 위해 절편을 준비할 때 관절 연골이 접히지 않도록 각별히 주의해야 합니다. 일반적으로, 파라핀을 제거하고 조직을 슬라이드에 부착하기 위해 슬라이드를 60°C에서 밤새 굽습니다. 그러나 관절 연골이 있는 검체의 경우 이러한 결과를 얻지 못한다는 것이 확인되었습니다. 실제로, 밤새 구운 후 접힐 확률이 크게 증가합니다. 실온에서 완전히 자연 건조되도록 밤새 절편을 놓아 둡니다. 건조 후, 섭씨 37°에서 최소 12시간 동안 슬라이드를 슬라이드 건조기에 수평으로 올려 놓습니다. 많은 경우에 슬라이드를 주말 동안 슬라이드 건조기에 남겨둡니다. 모든 염색은 수동으로 실시하고, 이를 통해 검체가 요구하는 부드러운 방식으로 취급할 수 있습니다. 슬라이드를 너무 빨리 움직이거나 부딪치는 경우, 뼈와 관절이 접혀 슬라이드에서 들어올려질 수 있습니다. 그 후, 자일렌, 100% EtOH, 95% EtOH, 70% EtOH로 연속적으로 각각 5분 동안 슬라이드를 처리하여 검체를 탈수시킵니다. 검체를 탈수시킨 후, 염색 전 실온에서 30분 동안 완전히 건조될 때까지 놓아둡니다(그림 3). 경험상, 이는 관절 연골 접힘을 줄이는 데 중요한 단계입니다. 절편이 완전히 건조된 후, 평소와 같이 염색 절차를 진행합니다. 관절 연골 접힘을 방지하는 또 다른 핵심 요소는 재수화 단계를 위해 70% EtOH, 95% EtOH, 100% EtOH로 연속적으로 처치한 후 다시 절편을 자연 건조시키는 것입니다. 슬라이드가 완전히 건조된 후 자일렌과 커버슬립에 담급니다.
관절 연골 접힘을 피하기 위해 면역조직화학을 실행하는 동안 탈수와 재수화 과정에 사용한 동일한 단계를 사용할 수 있습니다.
Immunohistochemistry
열 유도 항원 복구를 필요로 하는 면역조직화학 프로토콜은 연골과 뼈에 손상을 야기할 수 있습니다. 고온으로 인해 뼈와 관절이 슬라이드에서 완전히 들어올려지거나 주름져 인공물이 발생할 수 있습니다. 면역조직화학 프로토콜이 열 복구 사용을 요구하는 경우, 온도를 낮추고 배양 시간을 연장합니다.
상해 또는 표면 손상 후 관절 연골을 측정하기 위해 조직형태계측법을 사용하는 경우, 관절 연골이 접힐 수 없습니다. 연골 접힘은 검체의 정확하지 않고 대표적이지 않은 측정치를 제공할 것입니다.
관절 연골 검체와 절편을 조심스럽고 부드럽게 취급하는 것이 중요합니다. 조직 해부로부터 슬라이드 봉입까지 적절한 조직학적 단계를 따르는 것이 질적인 관절 연골 절편을 얻는 데 중요합니다.
이 프레젠테이션은 뉴욕 주 로체스터 대학(University of Rochester)의 조직학 매니저인 사라 맥이 준비했습니다.
발표자 소개

Sarah A. Mack has over a decade of experience as a histotechnician, with a main focus on preparation, processing and analysis of both calcified and soft tissues of the musculoskeletal system. In addition to providing consulting, advice and assistance to clients of the HBMI Core, Sarah serves as its Manager, supervising all histology-based projects within the Center of Musculoskeletal Research. Sarah supervises the generation of musculoskeletal tissue biorepositories, and oversees the creation and maintenance of reagent stocks and standard protocols. She provides hands-on assistance in the preparation of histological tissues, including decalcification, automated paraffin processing, orientation before embedding and sectioning of paraffin and frozen tissue.
Sarah currently serves as Chair of the Hard Tissue Committee for the National Society of Histotechnology and as President of the New York State Histotechnological Society. She has been an active member in both societies for more than 15 years, providing information and knowledge to histologists that work in both scientific and clinical lab settings.
참조 문헌
- Skinner RA, Hickmon SG, Lumpkin CK, Aronson J, Nicholas RW. Decalcified Bone: Twenty Years of Successful Specimen Management. The Journal of Histotechnology 1997;20;267-277.
- Callis G, Sterchi D. Decalcification of Bone: Literature Review and Practical Study of Various Decalcifying Agents, Methods, and Their Effects on Bone Histology. The Journal of Histotechnology 1998;21;49-58.
- Animal Processing Manual. First ed., National Society Of Histotechnology, 2002.
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.