
표본 처리 방법 소개

세포와 조직을 현미경으로 분석하려면 유리 슬라이드 위에 올려놓은 아주 얇은 고품질 절편(슬라이스)을 전처리한 후 적절하게 염색하여 정상 구조와 비정상 구조를 확인해야 합니다
대부분의 신선 조직은 매우 섬세하면서 쉽게 변형되고 손상될 수 있으므로 얇은 절편을 화학적으로 보존을 하거나 박절하는 동안 어떤 식으로든 "고정"하지 않으면 전처리를 할 수 없습니다. 이를 지원하는 방법에는 크게 두 가지가 있습니다:
- 조직을 냉동시킨 후 동결 상태에서 절편을 박절하면 됩니다. 이러한 절편을 "동결 절편"이라고 합니다.
- 또는 조직 표본에 용제를 침투시켜 얇은 절편으로 박절할 수 있게 표본을 적절한 물리적 성질의 고체 상태로 변환하면 됩니다. 파라핀 왁스가 이러한 용제에 해당됩니다. 이러한 절차를 "파라핀 절편"이라고 합니다.
이 문서에서는 조직을 처리하여 절편을 만들 수 있도록 파라핀 포매 표본를 만드는 방법을 설명합니다.
개요
"조직 처리"에서는 동물이나 인간 조직을 고정부터 적절한 조직학용 왁스를 완전히 침투시켜 마이크로톰에서 절편 박절이 가능하도록 포매할 수 있는 상태까지 처리하는 데 필요한 단계를 설명합니다.
수동(직접 처리)으로 조직을 처리할 수 있지만 편의성과 효율성을 향상시키려면 자동 조직 처리 장비(“조직 처리기”)를 사용하여 표본 여러 개를 취급해야 합니다. 1940년대1 부터 이러한 장치를 사용했지만 더 안전하고 더 많은 표본를 더 빨리 처리하며 더욱 우수한 품질의 결과물을 제공하도록 지속적으로 발전하고 있습니다. 처리기에는 크게 두 가지 유형이 있습니다. 하나는 표본을 컨테이너에서 다른 컨테이너로 이동하여 처리하는 조직 이동(또는 "딥 앤 덩크") 장비고 다른 하나는 표본은 처리 챔버나 레토르트에 있고 유체가 필요에 따라 안팎으로 펌핑되는 유체 이동(또는 "밀폐형") 장비입니다. 최신 유체 이동 처리기에는 온도 상승과 효과적인 유체 순환 기능이 있으며 처리가 향상되고 처리 시간이 단축되도록 진공/압축 사이클이 통합되어 있습니다.
최신 밀폐형 조직 처리기



조직 처리의 중요성
대부분의 실험실 감독자들은 직원들에게 조직 처리의 중요성을 늘 강조합니다. 처리 일정이 부적절하거나 근본적인 실수(처리 시약 보충 또는 순서 등)가 발생하면 절편을 제작할 수 없는 조직 표본이 생성되어 유용한 현미경 검사 정보를 제공하지 못하게 됩니다. 표본 전체가 처리된 ("모든") 조직을 진단하는 경우에 문제가 될 수 있습니다. 여분의 조직이 없습니다. 그러므로 진단을 진행할 수 없습니다. 그러나 설명을 기다리고 있는 환자가 있습니다.
간혹 조직 처리기에서 기계적 또는 전기적 결함이 발생하는 경우도 있지만 조직이 실제로 손상되는 처리 사고의 대부분은 사람의 실수로 인해 발생합니다. 조직 처리를 수행하는 직원들에 대한 교육과 훈련의 중요성은 아무리 강조해도 지나치지 않으며 처리기를 설치할 때에도 특별한 주의가 필요합니다.
파라핀 절편에 사용되는 조직 처리 단계 개요
1. 신선한 표본 채취
신선한 조직 표본은 다양한 검체물에서 채취됩니다. 표본이 환자나 실험용 동물에서 절제하는 과정에서 쉽게 손상될 수 있다는 점에 유의해야 합니다. 표본은 매우 조심스럽게 취급해야 하며 절제 후 가능한 빨리 고정해야 합니다. 수술실과 같이 절제하는 장소에서 고정하는 것이 이상적입니다. 하지만 불가능한 경우 실험실로 즉시 옮겨야 합니다.
2. 고정
표본을 포름알데히드 용액(포르말린)과 같은 고정액에 넣습니다. 이러한 고정액은 조직에 서서히 침투하여 화학적 변화와 물리적 변화를 일으켜 조직을 경화시키고 보존하고 이후 처리 단계로부터 조직을 보호합니다.2 표본에 적합한 성질을 가지고 있어야 하므로 고정에 사용할 수 있는 시약의 수는 제한적입니다. 예를 들어 조직 구성 요소에서 화학적 반응을 일부 유지해야 나중에 특정 염색법을 적용할 수 있습니다.3 일반적으로 인산염완충 용액인 포르말린은 파라핀 절편을 전처리하기 위해 처리되는 조직을 보존하는 데 가장 많이 사용되는 고정액입니다. 고정액이 조직 모든 부분에 침투할 수 있도록 표본을 장시간 고정액에 담그는 것이 이상적이며 고정액의 화학 반응이 평형(고정 시간)에 도달할 수 있도록 추가 시간을 확보하는 것이 좋습니다. 즉, 일반적으로 6~24시간 동안 표본을 고정해야 합니다. 대부분 실험실에서는 고정 단계를 처리기의 첫 번째 스테이션으로 사용합니다.
고정 후 검사에 적합한 부위를 선택하기 위해 추가로 절제해야 할 수도 있습니다. 처리할 표본을 적절하게 라벨이 부착된 카세트(작은 구멍이 있는 바구니)에 넣어 다른 표본들과 구분합니다. 표본을 처리하는 데 소요되는 시간은 가장 큰 표본과 가장 작은 표본의 유형과 크기, 특별히 사용하는 처리기, 선택한 용제, 용제 온도 및 기타 요인에 따라 달라집니다. 다음 예는 6시간 동안 Leica Peloris™ 고속 조직 처리기를 사용한 결과입니다.
3. 탈수
녹인 파라핀 왁스는 소수성(물과 섞이지 않음)이므로 왁스가 표본에 침투할 수 있게 하려면 표본 내 대부분의 수분을 제거해야 합니다. 이를 위해 일반적으로 일련의 에탄올(알코올) 용액에 표본을 담그고 물이 없는 순수 알코올에 도달할 때까지 농도를 증가시킵니다. 에탄올은 모든 비율에서 물과 섞일 수 있으므로 표본 내 수분은 서서히 알코올로 바뀝니다. 농도를 단계적으로 증가시키면 조직의 과도한 변형을 방지할 수 있습니다.
두께가 4 mm 이하인 표본에 대한 일반적인 탈수 순서는 다음과 같습니다.
- 70% 에탄올 15분
- 90% 에탄올 15분
- 100% 에탄올 15분
- 100% 에탄올 15분
- 100% 에탄올 30분
- 100% 에탄올 45분
이때 표본에서 소량의 응집된 물 분자 잔여물을 제외한 모든 수분이 제거되어야 합니다.
4. 투명
이제 조직에서 수분이 제거되었지만 왁스와 에탄올이 거의 섞이지 않으므로 왁스를 조직에 침투시킬 수 없습니다. 따라서 에탄올과 파라핀 왁스 모두 완전히 섞을 수 있는 중간 용매를 사용해야 합니다. 이 용매는 조직 내 에탄올을 대체하고 곧 녹은 파라핀 왁스로 대체됩니다. 이 단계를 "투명"이라 하며 사용하는 시약을 "투명제"라고 합니다. 전부는 아니지만 대부분의 투명제가 상대적으로 높은 굴절률로 인해 조직에 광학적 선명성이나 투명성을 제공하므로 "투명"이라는 용어가 사용되기 시작했습니다. 투명제의 또 다른 중요한 역할은 왁스 침투를 방해하는 상당량의 지방을 조직에서 제거하는 것입니다.
가장 널리 사용되는 투명제는 자일렌이며 에탄올을 완전히 대체하기 위해서는 몇 가지 변화가 필요합니다.
두께가 4 mm 이하인 표본에 대한 일반적인 투명 순서는 다음과 같습니다 :
- 자일렌 20분
- 자일렌 20분
- 자일렌 45분
5. 왁스 침투
이제 조직에 조직학적으로 적합한 왁스를 침투시킬 수 있습니다. 수년 동안 다양한 왁스가 평가되고 사용되었지만 파라핀 왁스 기반 조직학적 왁스가 가장 널리 사용되고 있습니다. 일반 왁스는 60°C에서 액체 상태이며 이 온도에서 조직에 침투할 수 있습니다. 온도를 20°C로 낮춰 응고시키면 절편을 일정한 두께로 박절할 수 있습니다. 이 왁스는 정제된 파라핀 왁스와 스티렌이나 폴리에틸렌과 같은 수지가 포함된 다양한 첨가제의 혼합물입니다. 이러한 왁스에는 매우 특별한 물리적 성질이 있고 이 성질을 통해 왁스를 조직에 침투시켜 최소 2 µm 두께로 박절할 수 있고, 마이크로톰에서 절편을 박절하면 리본 모양이 형성되고, 온수조 부양 중에 절편이 완전히 평평해지도록 탄성이 충분하게 유지됩니다.
두께가 4 mm 이하인 표본에 대한 일반적인 침투 순서는 다음과 같습니다.
- 왁스 30분
- 왁스 30분
- 왁스 45분
6. 포매 또는 블록화
왁스를 표본에 완전히 침투시켰습니다. 지금부터는 절편을 박절하기 위해 마이크로톰에 고정할 수 있는 "블록" 형태로 만들어야 합니다. 이 단계에서는 "포매 센터"를 사용하여 녹인 왁스와 표본을 몰드에 채웁니다. 표본 위치가 "절단면"을 결정하므로 몰드에서의 표본 방향이 매우 중요합니다. 이때 진단 및 연구 조직학을 모두 고려해야 합니다. 카세트를 몰드 위에 올려놓고 이 위에 왁스를 더 얹은 후 전체를 냉각 판에 놓아 응고시킵니다. 블록이 완성되면 부착된 카세트를 몰드에서 제거하고 절편을 제작할 수 있습니다. 이때 조직이 올바르게 처리되면 조직 표본이 포함된 왁스 블록은 매우 안정적인 형태로 남아 중요 자료로 보존될 수 있습니다.


"자일렌-프리" 처리
자일렌은 조직 처리용 투명제로 널리 사용되고 있지만 독성 시약이므로 일부 실험실에서는 이소프로판올과 다른 자일렌 대체제와 같이 독성이 적은 물질을 사용하기도 합니다. 이 방법의 경우 침투 과정에서 이소프로판올이 표본에서 제거되도록 왁스 온도를 높여야 합니다.

고정과 처리를 통해 조직이 경화되므로 불가피하게 축소됩니다. 왁스가 조직에 침투할 때까지 조직이 20% 이상 축소되는 것으로 추정하고 있습니다. 이러한 점에도 불구하고 최적으로 전처리된 절편에서는 표본과 정확한 조직병리학적 진단 간의 차이점을 비교할 수 있는 뛰어난 형태학적 세부 사항을 일관되게 보여줍니다.
이론적으로나 실제적으로 절편을 가장 쉽게 제작할 수 있는 파라핀 블록은 상대적으로 균일하게 부드러운 경도 특성을 가진 동질적 조직(예: 신장)이며 이 조직에 왁스가 침투하면 조직이 포함되지 않은 고형화된 왁스와 유사한 경도 특성을 가집니다. 치밀하거나 섬유질의 조직 또는 부드럽고 딱딱한 표본 모두 동시에 존재하는 표본은 좀 더 까다롭습니다. 고형화된 왁스가 제대로 침투하지 않는 부분이 있기 때문입니다. 고정 및 처리하는 과정에서 블록 내 다양한 요소가 차등적으로 축소되므로 절편을 제작할 때 문제가 발생할 수 있습니다.
우수한 처리 및 포매 단계
환자부터 병리학자까지 조직 검사에 사용되는 조직 표본을 전처리하는 데는 주의, 역량 및 체계적인 절차가 필요합니다. 이 가이드에서는 실제 모범 사례와 일반적인 오류를 방지할 수 있는 간단한 방법을 설명합니다.
이 가이드에서는 우수한 조직 처리 및 포매 방법에 대한 팁을 설명합니다. 각 단계에서는 우수한 조직학 검사에 중요한 정보를 제공하고 수용할 수 없는 결과가 발생하는 경우 이러한 단계를 통해 문제를 해결할 수도 있습니다.
"101 Steps to Better Histology" 전문을 보고 싶습니까?
적절한 일정 활용
조직 유형과 크기에 적합한 일정을 선택했습니다.
부적절한 일정을 선택했습니다. 예를 들어 작은 내시경 생검에 일정이 너무 길거나 크고 지방 함량이 높은 유방 표본에 일정이 너무 짧습니다.
추가 고정
최적의 처리와 우수한 조직 형태를 위해서는 처리하기 전에 조직을 잘 고정해야 합니다. 표본이 제대로 고정되어 있지 않으면 포르말린 고정액으로 추가 처리합니다.
알코올이 불완전하게 고정된 표본에 직접 침투하면 영역 고정 (표본 외부에 고정된 상태, 더 깊숙한 영역에는 알코올 고정)이 발생합니다.
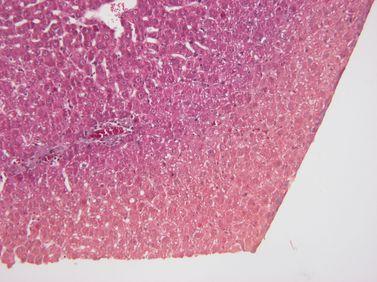
시약 품질 유지
처리용 시약은 지정된 지침에 따라 엄격하게 교체합니다. (라이카 바이오시스템즈의 펠로리스와 같은 고급 조직 처리기의 시약 관리 시스템을 사용하는 것이 좋습니다.)
처리용 시약 지침을 무시하면 즉, 효능이 없거나 오염되거나 희석된 시약을 사용하게 됩니다 (예: 펠로리스 시약 관리 시스템의 "임계값 초과" 경고 무시). 이렇게 되면 품질 저하 문제가 발생할 수 있습니다.
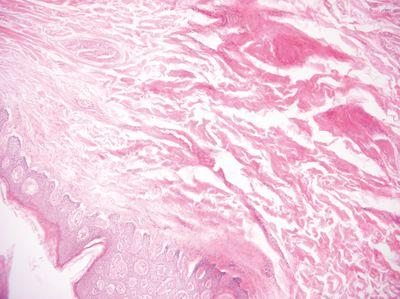
고품질 왁스 사용
고품질 왁스는 쉽게 박절할 수 있는 고품질 블록을 얻기 위해 침투 및 특히 포매(블록화)에 사용됩니다.
침투 및 포매에 출처를 알 수 없는 저렴하고 품질이 나쁜 왁스를 사용했습니다. 저품질 왁스로 인해 박절이 어려운 블록이 생성되었습니다

유해 시약 금지
가능하면 자일렌이 없는 프로토콜(예: 라이카 바이오시스템즈의 펠로리스 사용 시 제공되는 프로토콜)을 사용합니다. 그러면 처리 품질 저하 없이 실험실 환경이 안전해집니다.
자일렌 사용 시의 신체 영향을 전혀 고려하지 않았습니다. 대체제 사용 가능성도 염두에 두지 않았습니다.

신중하게 표본 방향 결정
주의 깊게 표본 방향을 결정합니다. 정확한 육안 검사를 위해 대다수의 표본 표면을 평평하게 합니다. 포매를 수행하는 직원들은 각 표본에 대한 설명을 언제든지 확인하고 해당 훈련도 받았습니다.
방향이 잘못되었습니다. 포매를 다시 수행해야 하므로 조직이 손실될 수 있습니다. 전처리가 잘못된 일부 표본은 절편 전면을 얻기 위해 마이크로톰에서 과도하게 다음어져야 합니다.
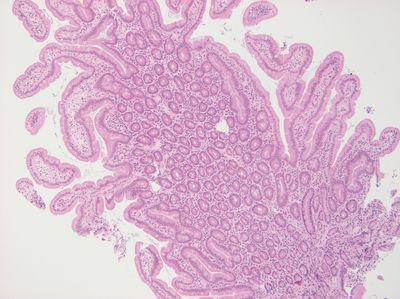
적절한 몰드 선택
항상 각 표본에 맞는 크기의 몰드를 선택합니다.
모든 표본에 같은 크기의 몰드를 사용합니다. 조직이 몰드 가장자리에 닿는 경우가 많습니다.


조심스럽게 표본 처리
포매 중에 표본을 조심스럽게 취급합니다.
강제로 포매 과정에서 표본이 몰드에서 평평해지도록 취급합니다. 이로 인해 조직 일부가 파손될 수 있습니다.
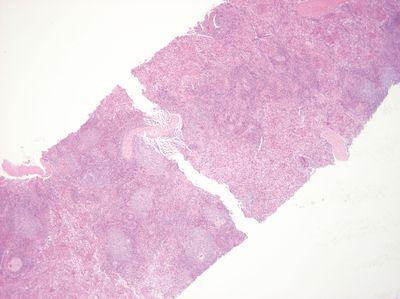
과도한 열 금지
조직을 취급하기 전에 왁스가 녹는 온도까지 겸자를 덥힙니다.
겸자를 왁스 용해점 이상으로 덥힙니다. 이렇게 하면 국소적 열 손상뿐만 아니라 접촉점과 가까운 부위의 형태학적 변화가 발생할 수 있습니다.
정기적으로 온도 확인
포매 중앙 핫 플레이트와 왁스 보관 탱크의 온도를 정기적으로 확인합니다.
포매 중앙 핫 플레이트 온도를 확인한 적이 없습니다. 이 처리 단계에서도 과도한 국소적 열로 인해 표본이 손상될 수 있습니다.
과도한 몰드 채우 금지
몰드를 넘치지 않도록 적정 수준으로 채웁니다.
절편 제작 전에 카세트의 뒷면과 가장자리가 긁힐 정도로 몰드를 과도하게 채워 넣습니다. 과도하게 채워진 블록은 마이크로톰 장착 시 불안정하게 놓여져 절편 제작 중에 조직이 손상될 수 있습니다.

발표자 소개

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
참조 문헌
- Clayden EC. Practical section cutting and staining. Edinburgh: Churchill Livingstone, 1971.
- Hopwood D. Fixation and fixatives. In Bancroft J and Stevens A eds. Theory and practice of histological techniques. New York: Churchill Livingstone, 1996.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 2007.
- Winsor L. Tissue processing. In Woods A and Ellis R eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.2-1 - 4.2-39.
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.