
면역 조직 화학: 개요 + IHC 면역염색 개선 단계


면역 조직 화학 ( IHC ) 은 조직학에서 정확한 종양 분류 및 진단에 유용한 특이적 단백질 마커 존재 유무를 감지하는 데 사용됩니다. 이 가이드에서는 IHC 은 조직학에서 정확한 종양 분류 및 진단에 유용한 특이적 단백질 마커 존재 유무를 감지하는 데 사용됩니다. 이 가이드에서는 IHC 면역염색의 기본 단계를 설명합니다.
면역 조직 화학이란?
면역 조직 화학 ( IHC ) 은 조직학에서 정확한 종양 분류 및 진단에 유용한 특이적 단백질 마커 존재 유무를 감지하는 데 사용됩니다. 이 가이드에서는 IHC 은 조직학에서 정확한 종양 분류 및 진단에 유용한 특이적 단백질 마커 존재 유무를 감지하는 데 사용됩니다. 이 가이드에서는 IHC 면역염색의 기본 단계를 설명합니다.
IHC 염색 소개
면역 조직 화학(IHC)은 조직학에서 정확한 종양 분류 및 진단에 유용한 특이적 단백질 마커 존재 유무를 감지하는 데 사용됩니다. 면역 조직 화학은 일반적으로 조직 형태(구조)를 보여주는 헤마톡실린 및 에오신(H&E) 및 특수 염색 기법을 보완하도록 진화하고 있습니다. H&E와 특수 염색은 비특이적이지만 IHC는 특이적 단백질 마커를 구분합니다. IHC는 고형암과 세포학적 표본을 진단하는 데 유용한 진단 도구이며 거의 반세기 동안 주요 진단 방법으로 사용되고 있습니다.
표적 항원
항원은 세포 표면 또는 내부에 존재하는 단백질입니다. 병리학자들이 진단을 위해 확인하는 것 중 하나가 특정 항원의 존재 여부입니다.
진단에 유용한 항원은 수백 개나 있습니다. 병리학자는 특정 종양을 정확하게 분류하기 위해 여러 개 항원 "패널"을 사용하는 경우가 많습니다.
일차 항체
IHC의 첫 번째 단계는 표적 항원과 명확하게 결합하는 일차 항체를 적용하는 것입니다.
항체에는 다클론 항체와 단클론 항체 등 두 가지 유형이 있습니다. 다클론 항체에는 친화력이 있어 여러 항원결정인자(또는 부위)나 표적 항원이 결합하므로 비표적 항원에 교차 반응이 일어나는 경향이 있습니다.
단클론 항체는 항원결정인자 하나에 대해서만 친화력이 있어 보다 선명하고 뚜렷한 염색이 가능하나 감도와 강도가 저하됩니다.
이차항체
다음으로 이차항체가 일차항체와 결합합니다. 이 방법을 간접 IHC라고 합니다. 여러 이차항체가 일차항체 하나와 결합하여 염색 강도를 증폭시키므로 현재 일반적으로 이 방법이 사용되고 있습니다.
검출 시스템
검출 시스템은 이차항체를 토대로 구축됩니다. 현재 색소 검출은 항체에 결합된 홍당무과산화효소(HRP)와 같은 효소를 활용합니다. 항체에 부착된 여러 효소들을 중합체라고 하며 색소원에 부착되는 분자가 증가할수록 염색 강도도 높아집니다.
색소원
마지막으로 현미경으로 관찰할 수 있는 불용성의 유색 침전물이 형성됩니다. 일반적으로 사용되는 색소원에는 DAB(갈색) 또는 AP(빨간색) 등 두 가지가 있습니다.
DAB가 가장 일반적으로 사용되며 이를 통해 강력한 영구 염색이 가능합니다.
AP Red(또는 다른 빨간색 색소원)는 갈색 멜라닌 색소로 인해 갈색 DAB가 보이지 않을 수 있는 피부 절편에 주로 사용됩니다.
병리학자가 한 단면에서 항원 두 개를 관찰할 수 있도록 동일한 조직 절편에서 DAB와 AP Red를 모두 사용하는 경우가 있습니다. 이러한 방식을 이중 염색이라고 합니다.
완벽한 IHC 염색
다음은 일반적인 IHC 염색으로, 갈색 침전물은 표적 항원의 존재를 나타냅니다. 다음 사례에서 표적 항원은 전립선 생검의 사이토케라틴 5(Cytokeratin 5)입니다. 염색 정도, 염색 패턴, 염색 위치(세포질, 핵 또는 세포막) 등 병리학자가 진단하는 데 사용하는 모든 정보를 제공합니다.
파란색 백그라운드는 주로 색소원 다음에 적용되는 헤마톡실린 대조 염색입니다. 대조 염색은 색소원에 대한 대비를 제공하므로 병리학자는 이를 통해 기저 조직 구조를 시각화할 수 있습니다.
IHC 면역염색을 향상시키는 15단계
환자부터 병리학자까지 조직 검사에 사용되는 조직 표본을 전처리하는 데는 주의, 역량 및 체계적인 절차가 필요합니다. 이 가이드에서는 실제 모범 사례와 함께 자주 발생하는 오류를 방지하기 위한 간단한 방법을 설명합니다.
IHC를 향상시키기 위한 팁도 설명합니다. 이 가이드가 올바른 조직학 사례에 대한 소중한 길잡이이자 각종 문제를 해결하는 데 유용할 것입니다
"101 Steps to Better Histology" 전문을 보고 싶습니까?
지금 더 나은 조직학을 위한 101단계를 다운로드하려면 여기를 클릭하십시오.
1단계 - 고품질 절편 사용
완전히 건조한 얇고 납작한 절편을 슬라이드에 올려 놓습니다. IHC 에 전하를 띈 슬라이드나 APES 코팅 처리된 슬라이드를 사용하는 것이 좋습니다.
균일하지 않고 제대로 점착되지 않은 절편은 염색 백그라운드가 무작위로 나타나 고르게 염색되지 않습니다.
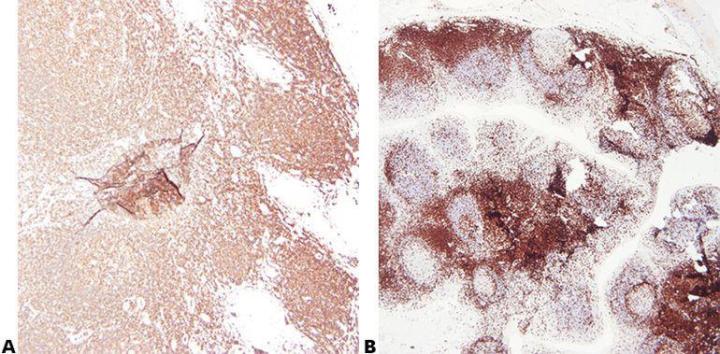
2단계 - 최적의 고정 상태 유지
일관된 고정 조건(고정액 유형, pH, 온도, 시간 등)으로 우수하게 고정하면 최고의 결과를 얻을 수 있습니다. 처리하기 전에 표본에 추가 고정이 필요한지 확인해야 합니다
고정 조건이 일관적이지 않으면(고정 부족 또는 고정 과잉) 가변적인 결과가 생성되어 문제 해결이 어려워집니다.

3단계 - 절편 점착 문제 방지
부양 수조, 특히 전하를 띈 슬라이드에 단백질 기반 절편 점착제 (접착제, 전분 또는 젤라틴 등)를 사용하지 마십시오
단백질 기반 점착제는 전하를 띈 슬라이드 표면을 차단할 수 있습니다. 이로 인해 점착이 일관되지 않아 절편이 위로 뜨고 그 아래에서 IHC 시약이 뭉쳐 균일하게 염색되지 않습니다.

4단계 - 농도 그라디언트 방지
농도 그라디언트를 방지하려면 시약을 정밀하게 도포해야 합니다.
"슬라이드 한쪽은 진하게 염색되지만 반대쪽은 약하게 염색되는 경우가 종종 발생합니다."
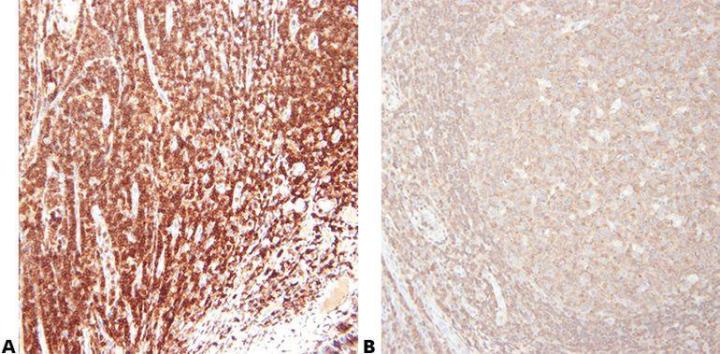
5단계 - 신중하게 항체 선택
감도와 특이성을 고려해 일차항체를 신중하게 선택합니다. 여러 공급업체에서 판매하는 항체라고 해도 포장이나 브랜드만 다를 뿐 소스는 동일한 경우가 많습니다. 항체를 평가할 때 클론 이름을 사용하는 것이 중요합니다.
"우리는 가격만 보고 항체를 구매합니다."

6단계 - 사용설명서 읽기
일차항체를 잘 알고 있어야 합니다. 항상 사용설명서를 확인하여 특정 항체에 적합한 방법을 결정합니다. 새로운 항체 배치를 구매하면 사용설명서를 업데이트해야 합니다.
"우리 실험실에서는 항체 사용설명서에 접근하지 못합니다."
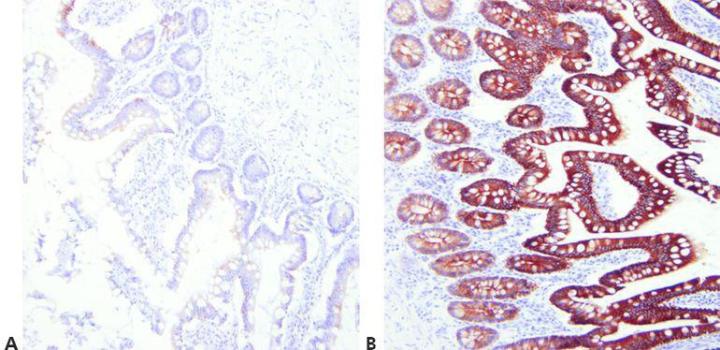
7단계 - 전처리 방법 최적화
사용하는 일차항체, 염색 중인 조직, 사용한 고정액(pH, 시약, 반응 조건 등)에 적합한 벗겨내기(retrieval) 조건을 선택합니다.
보편적이면서 성공적인 HIER 방법이 있다는 가정 하에 모든 일차항체에 동일한 방법을 사용합니다.
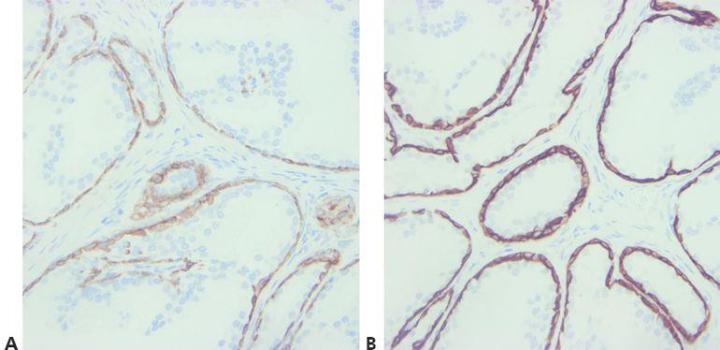
8단계 - 항체 교차반응성 고려
항체 교차반응성으로 발생할 수 있는 모든 문제에 유의합니다 (사용설명서 참고).
예상치 못한 양성 염색이 발생해도 원인을 찾으려고 하지 않습니다.
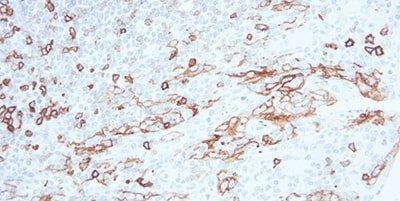
9단계 - 내인성 과산화효소 차단
과산화효소 기반 검출 시스템을 사용할 때는 항상 과산화효소를 차단합니다.
비특이적 염색은 주로 적혈구, 과립백혈구, 단핵구 및 근육에서 사용됩니다. 이는 완벽하게 차단되지 않은 내인성 과산화효소 때문입니다.
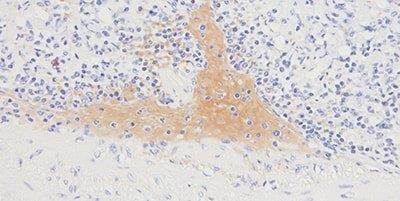
10단계 - 백그라운드 염색 방지
항상 적합한 단백질 차단제를 사용합니다
올바른 단백질 차단제를 사용하지 않으면 간혹 백그라운드가 염색됩니다.

11단계 - 적합한 검출 시스템 사용
적합한 감도로 정확하고 특이적으로 염색할 수 있는 적합한 검출 시스템을 선택합니다.
우리는 오랫동안 같은 검출 시스템을 사용해왔고 바꿀 필요를 느끼지 못합니다. 우리가 원하는 만큼 진하게 염색되지 않아 선명하지 않은 경우가 있어도 말입니다.
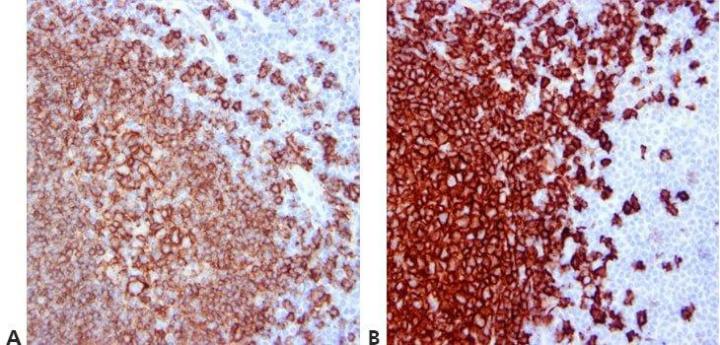
12단계 - 세척 단계 표준화
전체 과정에서 표준화된 세척 단계(지속 기간, 분량, 교반 형성 등)를 따릅니다. 이렇게 하면 일관성 있는 결과가 보장됩니다.
같은 항체로 여러 번 검사하거나 다른 날에 검사하는 경우 결과가 달라질 수 있습니다. 이는 서로 다른 운영자가 세척을 다르게 하면 발생할 수 있습니다.
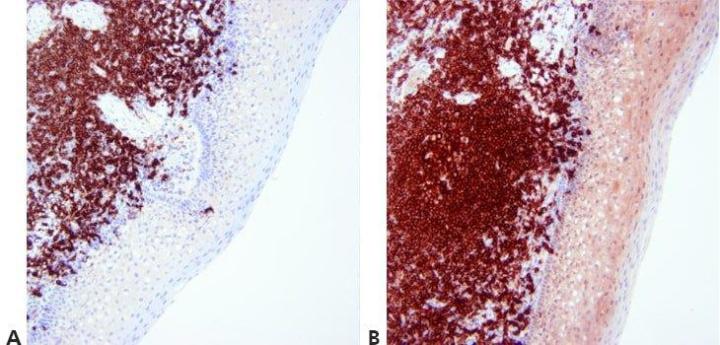
13단계 – 대조 염색 최적화
핵 대조 염색 수준을 신중하게 통제하고 표준화해야 양성 염색이 모호해지지 않습니다. 대조 염색은 색소원과 백그라운드 조직 요소 사이에서 명확한 대조를 보여줘야 합니다. 사용하는 색소원에 적합한 대조 염색을 선택합니다.
핵 대조 염색이 너무 진한 경우가 있습니다. 이로 인해 약한 특이 염색을 보기 어려울 수 있습니다.
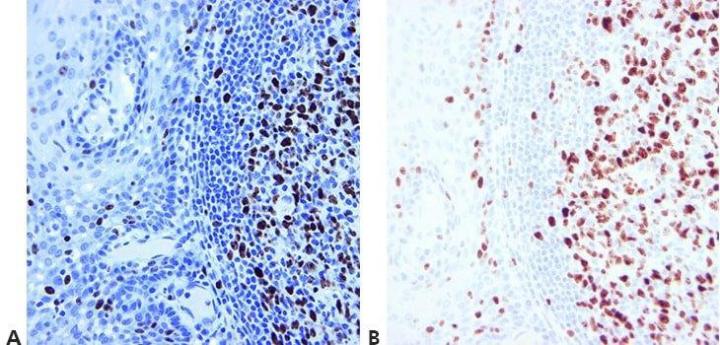
14단계 - 적합한 대조군 사용
항상 적합한 양성 대조군과 음성 대조군을 사용하여 결과를 주의 깊게 평가합니다. 양성 대조군과 음성 대조군은 IHC 품질을 보장하는 중요한 수단입니다.
"우리는 우리 방법이 적합하지 않는다고 판단한 경우에만 대조군을 활용합니다. 검사할 때마다 대조군을 사용했다면 사람들은 대조군을 검토하지 않을 것입니다."
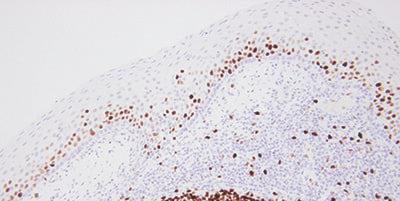
15단계 - 신중하게 결과 평가
염색 후 검사 절편과 대조군을 평가할 때 무엇을 어디서 확인해야 하는지 알고 있어야 합니다.
검사 절편에서 염색이 발견되었으면 염색이 잘 되었다고 추정할 수 있습니다.
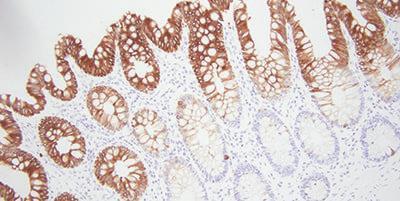
보너스 팁: 알맞은 항체 선택
간단하지만 흔히 간과하는 부분이 면역 조직 화학에 맞는 항체를 선택하는 것입니다. 이는 향후 원활한 검사를 위해 매우 중요합니다. 문헌, 공급업체 및 동료들을 통해 특정 항체를 검색합니다.
항체를 선택할 때 몇 가지 사항에 주의해야 합니다. 한 실험실에서는 전혀 문제가 아니었지만 다른 실험실에서는 문제가 될 수 있습니다. 염색 시스템으로 각 항체를 검사해야 합니다. 시간이 경과할수록 항체 염색 강도가 저하될 수 있습니다. 공기와 빛에 노출되면 특히 그렇습니다.
농축항체와 RTU 항체 간 비교
항체를 선택할 때 두 가지 주요 사항을 고려해야 합니다. 하나는 농축 형태이고 다른 하나는 즉시 사용 가능한(RTU) 희석 형태입니다. 농축항체는 유연하고 초기 구매 가격이 낮으며 일반적으로 자동 및 수동 등 모든 염색 시스템에서 사용 가능하고 제조업체의 권장 사항을 따릅니다. 비용, 염색 시간 및 품질을 고려해 농축물의 희석 배수를 최적화할 수 있습니다. 광범위하게 농축항체 희석 배수를 조정할 수 있으므로 실험에 대한 변경 사항이나 특정 항체의 여러 프로토콜에 맞춰 언제든지 희석배수를 변경할 수 있습니다. 하지만 농축항체에는 전처리 시간이 필요하며 평가를 거쳐야 합니다. 잘 통제된 환경에서 진행한 실험이 아니라면 희석된 항체의 특성이나 안전성을 장담할 수 없으므로 감지하기 힘든 미세한 문제들로 인해 염색 품질이 저하될 수 있습니다. RTU의 장점으로는 실험 효율성 증대, 엄격한 품질 통제 및 간편한 시약 관리를 들 수 있습니다. 희석 배수, 전처리 및 검사 평가에 소요되는 시간을 줄여줍니다. 검사 간 차이가 줄어들어 일관성이 향상되며 특히 자동 염색과 관련 검출 시스템에서 이러한 현상이 두드러집니다. RTU에는 검사 횟수, 제조업체에서 확인한 유통기한이 정해져 있어 항체 관리가 간소화됩니다. 또한 평가 작업도 크게 줄어들어 새로운 항체 분석을 손쉽게 채택할 수 있게 하므로 RTU는 실험실 성장에도 기여합니다.
보너스 팁: 염색 전 표준화가 매우 중요합니다
병리학자, 실험실 관리자 또는 조직 검사학자 여부에 관계없이 IHC 참고 문헌에는 형태학과 항원성을 유지하기 위한 최적의 조직 고정,처리 및 박절에 대한 조건들이 설명되어 있습니다. 이 요소들을 정확히 통제하면 일관성이 유지되는 개선안이 도출될 수 있습니다. 예컨대 실험실 자체를 수집 장소로 지정하고 수집 등록 및 표본 전처리의 출발점으로 인식할 수 있습니다.
표준화된 전처리 장비("통제된" 포트, 고정액)로 최적의 처리 다운스트림을 모니터링할 수 있도록 자동 수집 등록, LIS 및 표본 추적 인프라를 실험실뿐만 아니라 수술/생검에도 적용해야 합니다. 이런 표준화의 중요성을 알고 이를 업무에 적용한 유사 업종은 혈액 분석 실험실로, 표준화되고 코팅 처리된 바이얼에 바코드를 부착하여 환자 정보를 추적하고 수집 등록합니다.
고정, 조직 처리 및 IHC 염색을 유기적으로 연결하면 IHC 더욱 엄격하게 품질을 통제할 수 있습니다. 고정 및 조직 처리 조건을 모니터링하고 IHC 프로토콜과 연결할 수 있는 실험실은IHC 품질이 더욱 엄격하게 통제된 환경에서 진단 보고서를 작성할 수 있습니다. 변동성을 사전 처리하는 데 대조군을 자주 사용하면(예: 슬라이드 100개마다 대조군 사용) 염색 장비의 허용 오차와 성과를 더욱 효율적으로 측정할 수 있습니다. IHC 이러한 워크플로와 기술을 통해 IHC 산업이 성장하면서 발전합니다. 하지만 IHC 염색 결과의 일관성과 고품질을 유지하려면 다음 사항을 유의해야 합니다.IHC 염색(아래 표 참조).
| 단계 | 장소 | 영향을 미치는 주요 요인 IHC에 |
|---|---|---|
|
절제/생검 |
수술실/의사 진료실 |
절제 장비로 인한 기계적 조직 손상 |
|
수집 등록 |
실험실 |
표본 표지 처리 오류 |
|
육안 검사 |
실험실 |
너무 두꺼운 슬라이스 |
|
조직 처리 |
실험실 |
부족한 탈회(필요 시) |
|
포매 |
실험실 |
잘못된 방향 |
|
절편 제작 |
실험실 |
저품질 나이프 또는 잘못된 나이프 프로필 |
|
부유 |
실험실 |
더럽거나 오염된 물 |
발표자 소개

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.

Steven Westra is a renowned antibody staining consultant with over ten years of experience in the immunohistochemistry industry.
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.