
헤마톡실린의 화학적 기본 성질

헤마톡실린 염색 프로토콜은 조직학 실험실에서 수행하는 가장 일반적인 염색 방법입니다. 또한, 헤마톡실린 염색 프로토콜은 실험실에서 가장 오래된 프로토콜 중 하나이며, 약 100여년 전부터 사용되어져 왔습니다. 헤마톡실린은 알루미늄 이온이 결합된 헤마톡실린 용액으로 세포핵의 염색질을 염색하는 데 사용됩니다. 최근 세포 생물학과 분자 병리학의 발전으로 진단 병리학이 상당히 발전했음에도 헤마톡실린 염색을 통해 드러난 핵 크기와 모양 변화, 그리고 염색질 패턴의 변화는 여전히 병리학적 변화를 평가하는 데 있어 핵심 진단 표지자로 사용되고 있습니다. 진단 병리학에서 헤마톡실린의 중요성과 관련성에도 불구하고, 헤마톡실린의 화학적 특성은 아직까지 제대로 연구되지 않고 있습니다. 다음 논문에서는 알루미늄 이온이 결합된 헤마톡실린 염색제의 화학적 특성과 염색 시약이 작용하는 원리에 대해 현재까지 진행된 연구를 살펴봅니다
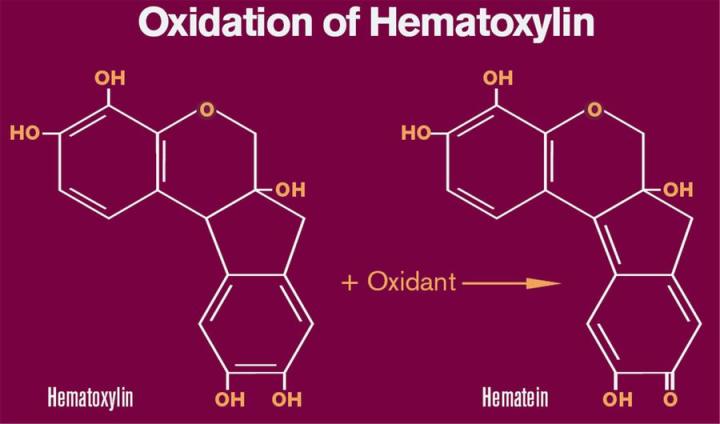
헤마테인의 산화 및 형성
헤마톡실린은 로그우드(캄파치 나무)에서 추출한 천연 화합물입니다. 헤마톡실린은 무색에 가깝고 산화 작용을 거치지 않을 경우 생물학적 염색제로서 별 가치가 없습니다. 염색 시약으로 “헤마톡실린”이라는 용어를 사용하는 것이 다소 오해의 소지가 있지만 편의상 이 용어로 계속 사용되고 있습니다. 염색 시약으로 사용하려면 헤마톡실린은 산화 과정을 거쳐 헤마테인으로 변한 후 알루미늄(Al+3), 철(Fe+3), 크롬(Cr+3)과 같은 여러 금속 이온 중 하나와 결합되어야합니다. 염색 시약과 결합하여 조직에 염료를 입히는 역할을 하는 금속 이온을 매염제라고 합니다. 이 글에서는 세포핵 염색제로서 헤마톡실린과 결합하는 알루미늄의 화학적 특성에 대해 자세히 알아봅니다.
헤마톡실린에서 헤마테인으로 변할 때 다수의 물질이 작용합니다. 델라필드(Delafield) 및 에를리히(Ehrlich) 헤마톡실린과 같이 오래된 시약은 공기 중 산소를 이용해 산화 과정을 거칩니다. 이 시약은 헤마톡실린과 알루미늄 염의 산화를 촉진하기 위해 느슨하게 마개를 씌우거나 솜으로 병을 막아 보관합니다. 헤마톡실린 용액에 공기 거품을 발생시켜 산화 속도를 가속화하는 방법도 사용되었습니다. 이러한 조건 하에서 헤마톡실린을 “자연 숙성”시키거나 산화시키는 데 약 4~10주 정도 필요했기 때문에 요즘은 이 과정을 거의 사용하지 않습니다. 현재 대부분의 시약은 요오드산나트륨과 같은 화학적 산화제를 사용하여 헤마톡실린을 헤마테인으로 빠르게 변화시킵니다. 요오드산나트륨의 농도는 보통 헤마톡실린의 양에 비례하며, 일반적으로 헤마톡실린 1g당 요오드산나트륨 0.10 ~ 0.20g 정도입니다. 수은 산화물은 수년 동안 해리스 시약에서 산화제로 사용되었으나 수은이 환경 문제를 야기해 더 이상 사용하지 않습니다. 요즘은 변형된 해리스 시약에 수은 산화물 대신 요오드산나트륨을 사용합니다.
분자 구조가 명확하게 밝혀진 헤마톡실린과는 달리 헤마테인의 분자 구조는 최근 몇 년 동안 논란의 대상이 되고 있습니다. 그림 1은 퀴노이드 링이 있는 기존 헤마테인 구조입니다. 헤마테인의 정확한 구조와는 별개로 NMR 분석과 분자량의 유사성을 토대로 헤마테인이 헤마톡실린의 구조와 유사하다고 가정할 수 있습니다. 구조가 변하면 무색에 가까운 헤마톡실린이 적갈색 헤마테인으로 변합니다. 또한, 알루미늄과 같은 금속 이온을 결합하려면 헤마테인으로 산화되는 과정을 거쳐야 합니다.
염료 레이크(Lake) 형성
Al+3 공급원으로 다양한 알루미늄 염이 사용됩니다. 여기에는 황산 알루미늄 암모늄[AlNH4(SO4)2], 황산 알루미늄[Al2(SO4)3], 황산 알루미늄 칼륨[AlK(SO4)2] 등이 해당됩니다. 메이어(Mayer) 및 해리스(Harris) 시약에는 보통 AlNH4(SO4)2 또는 AlK(SO4)2가 사용되며, 길(Gill) 시약에는 Al2(SO4)3가 사용됩니다. 사실 이 알루미늄 염들은 용액에 기여할 수 있는 Al+3의 양 외에는 크게 차이가 없습니다. AlNH4(SO4)2와 AlK(SO4)2는 수용액에서 잘 용해되지 않으며, 대부분의 조건에서 완전하게 이온화되지 않아 Al+3를 생성하지 않습니다.
일반적으로 헤마테인이 Al+3와 결합하여 복합체, 즉 “레이크(lake)”를 형성한다고 알려져 있으나 이 복합체의 성질이나 구조는 아직 완전하게 규명되지 않았습니다. 지난 50년 동안 헤마테인-Al+3 복합체의 전체 전하량뿐만 아니라 Al+3 분자의 비율도 논쟁의 대상이 되어 왔습니다. 대부분의 증거는 헤마테인-Al+3 복합체가 대부분의 염색 조건에서 양전하, 즉 “양이온”이라는 개념을 뒷받침합니다.
위에서 설명한 산화제 및 알루미늄 염 외에도 헤마톡실린 용액에는 다른 첨가물 또는 물질이 들어있습니다. 글리세린이나 더 많이 알려진 에틸렌글리콜과 같은 다가 알코올을 첨가하면 용매의 화학적 구조가 변합니다. 초기에는 다가 알코올이 헤마테인의 과잉 산화를 줄이기 위한 안정제 역할을 하는 것으로 알려졌습니다. 실제로 이러한 첨가제는 주로 헤마테인과 헤마테인-Al+3 복합체가 더 잘 용해되도록 돕는 작용을 합니다. 헤마톡실린은 비교적 잘 용해되지만, 헤마테인과 헤마테인-Al+3 복합체는 물에서는 거의 용해되지 않습니다. 헤마테인-Al+3 복합체는 침전되어 용액 표면에 침전물 또는 금속 광택을 형성할 수 있습니다. 에틸렌글리콜을 용액에 첨가하면 이러한 부산물의 침전이나 침전물을 감소시켜 헤마톡실린 용액의 안정성 또는 사용 기한을 늘려줍니다.
때때로 pH를 줄이기 위해 헤마톡실린 용액에 다양한 산성물질을 첨가하기도 합니다. 아세트산은 길(Gill) 헤마톡실린에 첨가되며, 구연산은 메이어(Mayer) 헤마톡실린에 첨가합니다. 헤마톡실린 용액에 산을 첨가하면 비특이적 배경 염색을 감소시켜 핵에 대한 염색의 선택성이 증가합니다. pH 감소가 염색에 미치는 영향은 “염색 과정”에서 자세히 다룹니다.
염색 과정
헤마테인-Al 복합체에 의한 세포핵 염색을 설명하기 위해 많은 다양한 이론이 제안되었습니다. 헤마테인-Al 복합체 결합에 관여한다고 주장된 핵 분자에는 디옥시리보핵산(DNA)과 히스톤과 같은 염기성(양전하) 단백질이 있습니다. 현재 염기성 핵 단백질이 헤마테인 복합체를 결합시킨다는 주장을 뒷받침하는 증거는 없습니다. 오히려 헤마테인-Al+3 복합체가 DNA에 결합한다는 이론이 더 일치합니다. 이 이론을 뒷받침하는 증거에는 DNase 효소를 활용하는 연구가 있습니다. 이 연구에서는 핵 DNA가 분해되면서 헤마테인/AI 용액이 모든 핵 염색을 차단한다는 사실을 밝혀냈습니다.
헤마테인-Al+3 복합체가 DNA를 유인하거나 결합하는 이유는 염색 조건에서 인산기가 음전하를 가지고 있기 때문에 양이온인 헤마테인-Al+3 복합체가 정전기적으로 끌려서 발생할 수 있습니다. 이 이론은 또한 뮤신이나 프로테오글리칸에서 발견되는 다른 음이온이 헤마테인-Al+3 복합체 결합으로 배경 염색을 만들 수 있다는 관찰 결과와도 일치합니다. 실제로, 배경 염색은 헤마테인-Al+3 복합체 용액의 pH를 낮춤으로써 감소될 수 있습니다. pH가 감소하면 음이온이 있던 상당 부분이 중성자가 되도록 양성자화(수소 원자(H+) 추가)될 수 있습니다. 중성 전하에서 이러한 물질들이 더 이상 양전하를 띈 헤마테인-Al+3 복합체를 결합시키지 않기 때문에 정전기 인력이 헤마테인-Al+3 결합의 매개체 역할을 한다는 사실을 입증합니다.
이는 단순히 정전기 인력만으로 헤마테인-Al+3 복합체 용액으로 핵 염색을 설명하기에는 충분하지 않다는 점을 시사합니다. 이 이론은 정전기력이 DNA로 헤마테인-Al+3 복합체를 유인하는 매개체 역할을 하지만, 정전기에 의한 결합은 보다 안정적인 공유 결합 또는 배위 공유 결합으로 대체될 수 있다는 가정에 기초합니다. 공유 결합의 안정성이 더 높으면 헤마테인-Al
복합체 염색의 상대적 영구성에 대한 설명이 가능해집니다. 하지만 헤마테인-Al+3 복합체와 DNA 결합에서 공유 결합의 역학을 뒷받침하는 직접적인 증거는 거의 없습니다.
그림
발표자 소개

Russell Myers acquired his Ph.D. in endocrine physiology from the Medical College of Georgia. Russell Myers is responsible for design and development of reagents and consumables used in the histology laboratory.
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.