
특수 염색방법 – 어떤 조직을, 어떻게, 왜? 제 2부: 결합조직

결합조직 – 서론
결합조직은 세포와 기관들을 연결하는 매트릭스를 제공함으로써 몸을 지탱합니다. 체내에는 세 종류의 결합조직이 있습니다.
첫번째로, 콜라겐(Collagen) 은 강력한 단백질이며 인대와 힘줄을 구성하는 주요 성분입니다. 또한 피부 탄력을 담당하며 H&E.를 통해서 볼 경우 가장 잘 나타나는 유형입니다.
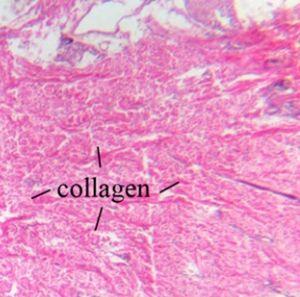
두번째로, 탄력섬유(Elastic Fiber)는 피부와 혈관 벽에 있으며 탄력소(elastin)라는 단백질로 구성되어 있습니다. 탄력소(elastin)는 유연하고 체내의 많은 조직들이 늘어나거나 줄어든 이후에 원래의 모양으로 돌아올 수 있도록 하는 단백질이며, H&E에서 나타나지 않습니다.
마지막으로, 세망섬유(Reticular Fiber)는 콜라겐으로 구성되어 있으며 신경섬유, 지방세포, 림프절, 평활근 섬유와 골격근 섬유 주변으로 섬세한 구조를 형성합니다. 또한 H&E에서는 나타나지 않습니다.
결합조직 관찰용으로 가장 많이 사용되는 염색방법
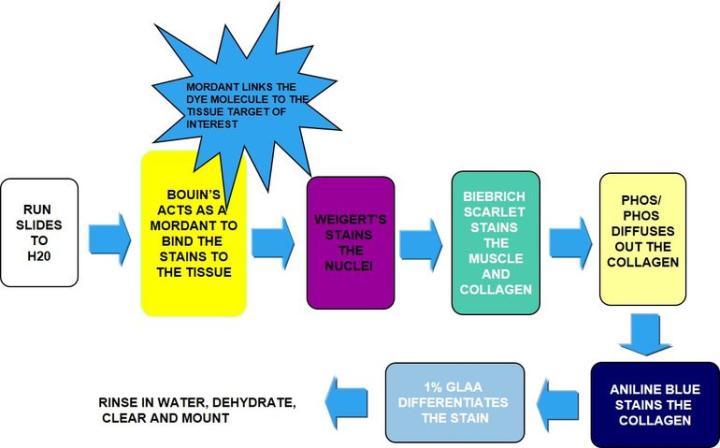
Trichrome – Masson염색
근육 (빨강), 콜라겐 섬유 (파랑), 적혈구 (빨강), 핵 (검정) 등을 포함하여 세 가지 염료가 선택적으로 염색하는 데 사용됩니다.
이 염료들은 간생검 조직을 염색하여 간경화에서의 섬유화 정도를 결정하거나 신장 생검 조직을 염색하여 기저막을 강조하고 면역 침착물을 표현하기 위하여 사용됩니다. 염료들은 또한 종양에서 평활근과 콜라겐을 분별하고 콜라겐의 증가를 확인하는데 사용됩니다.
과정
결과

프로토콜 – (인큐베이션 시간은 제조사 가이드라인에 따라 다를 수 있습니다.)
|
1. |
슬라이드를 물에 담금 |
|
|
2. |
Bouin 용액에 인큐베이션 – 조직염색전에 매염 역할 함 |
|
|
Overnight |
|
|
10-15 mins |
|
|
3. |
흐르는 물에 남아있는 Bouin 용액 수세(Washing)-모두 제거 |
|
|
4. |
Weigert’s 헤마톡실린 염색 |
5-10 mins |
|
5. |
염색 후, 흐르는 물에 수세(Washing) |
5 mins |
|
6. |
Biebrich scarlet으로 염색 |
15 mins |
|
7. |
염색 후, 흐르는 물에 수세(Washing) |
|
|
8. |
P.T.A.-P.M.A.(Phosphotungstic/phosphomolybdic acid)용액으로 처리 |
15 mins |
|
9. |
아닐린 블루(Aniline blue) 용액으로 염색. - No Washing |
5 mins |
|
10. |
바로 1% 글라시알 아세트산 (glacial acetic acid)로 수세(washing) |
1-3 mins |
|
11. |
흐르는 물에 수세(Washing) |
|
|
12. |
탈수, 투명, 봉입 |
Trichrome 염색 문제 해결 :
적정 온도에서 적정 인큐베이션 시간에 좋은 Bouin 용액 사용이 중요합니다. P.T.A.-P.M.A.(Phosphotungstic-phosphomolybdic acid)처리 과정을 붉은색이 모두 제거되면서 콜라겐을 구분합니다. 만약 근육의 붉은색이 옅으면 Bouin 용액 또는 Biebrich scarlet을 확인합니다. 만약 콜라겐이 너무 옅으면, 1% GLAA에서의 인큐베이션 시간을 줄입니다. 핵 – 검은색.
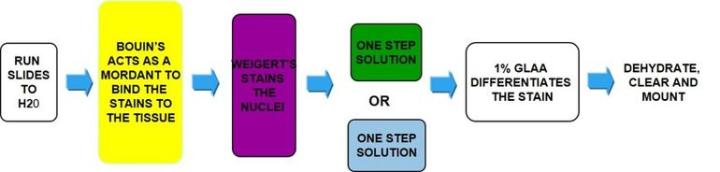
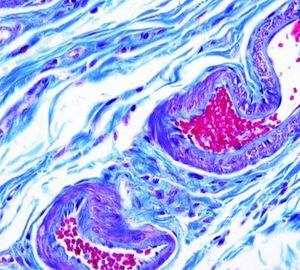
원스텝 Trichrome – 고모리 염색 (One Step Trichrome - Gomori's)
한 가지 용액이 근육, 콜라겐 섬유, 섬유소, 적혈구 모두를 염색할 수 있습니다. 두 가지 방법이 있습니다. 파랑 – Masson 용액과 같이 콜라겐(Collagen)이 파란색으로 선호하는 경우. 초록 – 콜라겐(Collagen)이 초록색으로 선호하는 경우. 하지만 다른 모든 결과는 Masson과 비슷한 결과입니다.
과정
결과
프로토콜
인큐베이션 시간은 제조사의 가이드라인에 따라 다를 수 있습니다.
|
1. |
슬라이드를 물에 담금 |
|
|
2. |
Bouin 용액에 인큐베이션 – 조직에 염료를 부착하는 매개체 역할 |
|
|
Overnight |
|
|
10-15 mins |
|
|
3. |
흐르는 물에 남아있는 Bouin solution 수세(Washing)-모두 제거 |
|
|
4. |
Weigert’s 헤마톡실린 염색 |
5-10 mins |
|
5. |
염색 후, 흐르는 물에 수세(Washing) |
5 mins |
|
6. |
One step blue/green solution 으로 염색 |
15 mins |
|
7. |
바로 1% 글라시알 아세트산 (glacial acetic acid)로 수세(washing) |
1 min |
|
8. |
흐르는 물에 수세(Washing) |
|
|
9. |
탈수, 투명, 봉입 |
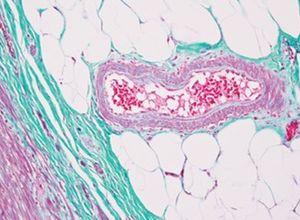
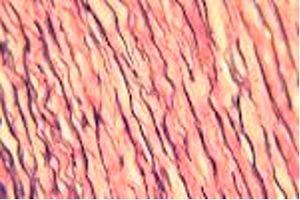
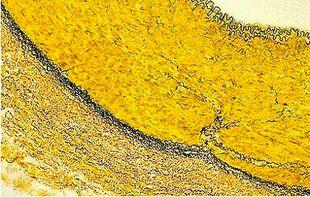
Verhoeff's van Gieson Elastic 염색
Verhoeff's van Gieson Elastic Stain 용액은 폐공기증과 같이 탄력 조직(elastic tissue)의 위축, 혈관 질환 (동맥경화증)의 증거, 종양(Tumor)이 혈관침투 여부를 확인하기 위하여 사용됩니다
과정
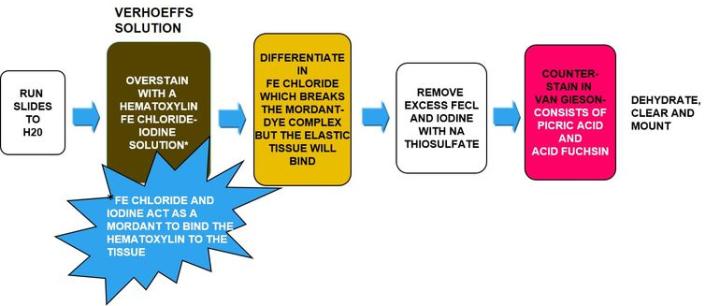
결과
프로토콜
인큐베이션 시간은 제조사의 가이드라인에 따라 다를 수 있습니다.
|
1. |
슬라이드를 물에 담금 |
|
|
2. |
Verhoeff’s elastic stain solution - 작업 용액 (제조사에 따라) |
15 분 |
|
3. |
흐르는 물에 수세(Washing) |
|
|
4. |
2% 염화철(ferric chloride)에 담가 감별염색 |
1-2 분 |
|
5. |
염색 후, 흐르는 물에 수세(Washing) |
5-10 mins |
|
6. |
5% 티오황산나트륨 (sodium thiosulfate) |
1 min |
|
7. |
흐르는 물에 수세(Washing) |
|
|
8. |
van Gieson 용액으로 대조염색 |
30 초 - 1 분 |
|
9. |
95% 건너뛰고 빠르게 100%에서 탈수 2회 |
|
|
10. |
투명 및 봉입 |
탄력 염색법 - 문제 해결
Verhoeff 용액은 산화 작용이 급속도로 일어나 매번 사용 시 새 것을 사용해야 합니다. 염색시약 분자가 조직 분자와 마찬가지로 ferric chloride를 좋아하기 때문에 조직으로부터 쉽게 분리될 수 있고 처음부터 전부 다시 시작해야 할 수 있으므로 ferric chloride에서 너무 오래 분별하지 말아야 합니다. 몇 초간 인큐베이션 후 빠르게 헹구고 탄력 조직 섬유를 찾아 현미경으로 관찰합니다. 조직 섬유들이 검정으로 보이고 콜라겐과 다른 조직 유형들과 분별 되면 과정을 중단합니다
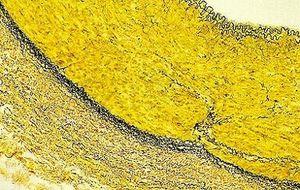
마찬가지로, 용액 속에 있는 피크린산 (picric acid)는 부착된 헤마톡실린을 계속하여 분별할 수 있기 때문에 너무 오래 인큐베이션 하면 안됩니다.
고모리 세망섬유 섬유(Gomori's Reticulin Fiber)
세망섬유(Reticulin fiber)는 몸을 지탱하며 간(Liver), 비장(Spleen), 신장(Kidney)에 흔하게 발견됩니다. 특징적인 세망 패턴은 간 경화(cirrhosis of the live), 골수의 초기 섬유화, 그리고 혈관을 구성하는 세포 종양인 혈관 육종(hemangiosarcomas), 섬유선종(fibroblastic tumors), 뼈에 부착되는 근육 종양인 횡문근육종(rhabdomyo sarcomas) 등을 포함한 여러 종양을 진단하는 데 도움됩니다. 또한, 상피(epithelial)종양과 비상피(non-epithelial) 종양을 진단하는 데 도움을 줍니다
세망섬유 염색은 은을 사용하며 섬유의 은친화성 성질에 의존합니다. 은친화성 세포는 은을 흡착할 수는 있지만, 환원시킬 수는 없습니다. 흡착(adsorb)은 표면에서 일어나는 과정인 반면에 흡수(absorb)는 조직 사이로 침투하는 것을 의미합니다. 은친화성 세포들은 보이지 않는 은염을 보이는 금속 은으로 전환하기 위해 환원제 혹은 현상액(developer)이 필요합니다.
과정
결과
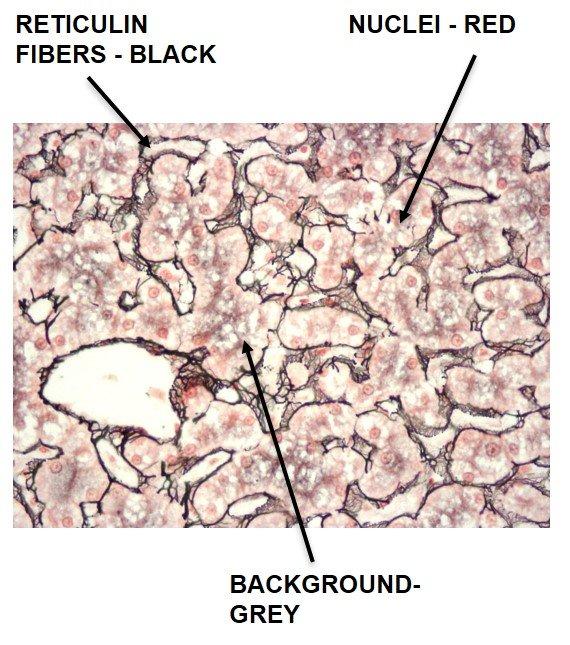
프로토콜
|
1. |
슬라이드를 물에 담금 |
|
|
2. |
과망간산 칼륨 (potassium permanganate)으로 산화처리 |
10 min |
|
3. |
흐르는 물에 수세(Washing) |
3 mins |
|
4. |
옥살산 (Oxalic acid)으로 환원 |
1 mins |
|
5. |
흐르는 물에 수세(Washing) |
2 mins |
|
6. |
암모늄 황산철 (ferric ammonium sulfate)으로 감작 |
15 mins |
|
7. |
증류수(DDW)에 수세(Washing) |
2 mins |
|
8. |
Ammoniacal silver 용액이 조직에 침투 |
2 mins |
|
9. |
증류수(DDW)에 수세(Washing) |
1 min |
|
10. |
20% 비완충 포르말린(unbuffered formalin)에서 현상 |
1 min |
|
11. |
흐르는 물에 수세(Washing) |
2 mins |
|
12. |
0.1% gold chloride에서 조색 |
3-5 mins |
|
13. |
물에 수세(Washing) |
1 min |
|
14. |
5% sodium thiosulfate 로 고정 |
1 min |
|
15. |
물에 수세(Washing) |
1 min |
|
16. |
Nuclear fast red 용액에서 대조염색 |
3-5 mins |
|
17. |
물에 잠시 수세(Washing) |
15 sec |
|
18. |
탈수, 투명, 봉입 |
고모리 세망 (Gomori’s reticulin) 문제 해결 :
은 용액(Silver solution)은 증류수(DDW)와 깨끗한 유리 용기로 새로 만들어야 합니다 (산 세척은 필요 없습니다). 주의하여 은을 만들어야 합니다. 오래되고 암모니아가 고갈된 수산화암모늄(ammonium hydroxide)을 사용하면 실패할 수 있습니다. 은/수산화나트륨 (ammonium hydroxide) 용액을 깨끗이 하기 위해 과도한 수산화암모늄을 사용해서는 안 됩니다. 과도한 수산화암모늄(ammonium hydroxide)을 사용할 경우 염색이 약하게 됩니다.
암모니아 처리 은 용액 만드는 법:
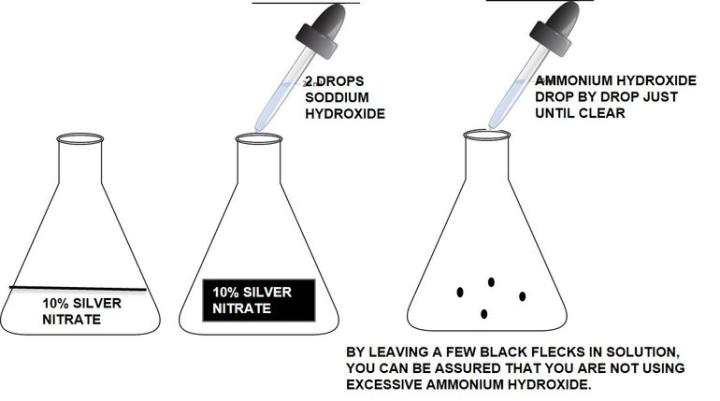
한 번의 절차로 콜라겐(Collagen), 탄력섬유(Elastic Fiber), 세망섬유(Reticular Fiber), 핵, 그리고 근육을 나타내는 방법
Movat Pentachrome 염색
Movat Pentachrome 염색은 강력한 결합조직 염색 방법입니다. 심장 조직, 혈관, 혈관 및 폐 질환을 연구할 때 사용됩니다. 콜라겐 (Collagen), 탄력, 섬유소(fibrin), 근육 섬유(muscle fiber)의 뛰어난 분별 때문에 Movat는 일반적인 염색으로 나타낼 수 없는 미묘한 변화를 표현할 수 있습니다.
과정
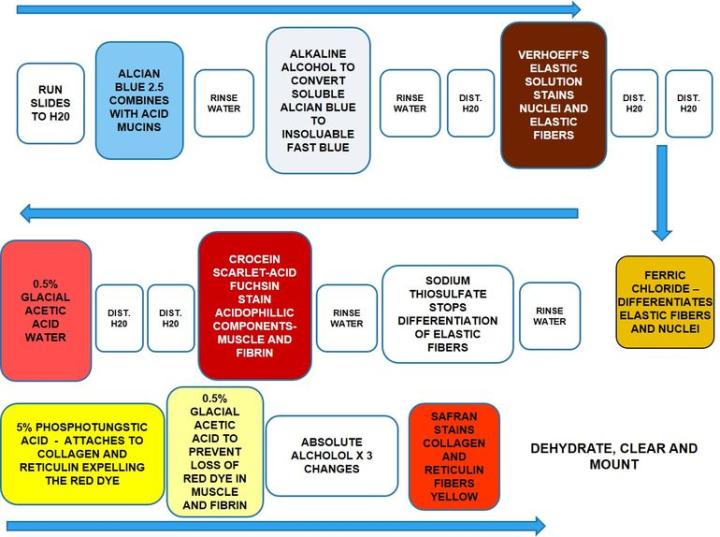
결과

프로토콜
인큐베이션 시간과 시약 순서는 제조사 가이드라인에 따라 다를 수 있지만, 결과는 비슷합니다.
|
1. |
슬라이드를 물에 담금 |
|
|
2. |
Alcian blue으로 염색 |
20 mins |
|
3. |
흐르는 물에 수세(Washing) |
5 mins |
|
4. |
Alkaline alcohol에 슬라이드 담금 |
60 mins |
|
5. |
흐르는 물에 수세(Washing) |
10 mins |
|
6. |
증류수(DDW)에 수세(Washing) |
|
|
7. |
Verhoeff’s elastic solution |
12 ~ 15 min |
|
8. |
증류수(DDW)에 수세(Washing) 2번 |
|
|
9. |
Ferric chloride에 감별 염색 |
2 ~ 3 번 담갔다 뺌 |
|
10. |
증류수(DDW)에 수세(Washing) |
|
|
11. |
Sodium thiosulfate에 슬라이드 담금 |
1 min |
|
12. |
흐르는 물에 수세(Washing) |
5 mins |
|
13. |
Crocein scarlet – acid fuchsin 에 슬라이드 담금 |
90 sec - 3 min |
|
14. |
증류수(DDW)에 수세(Washing) 2번 |
|
|
15. |
0.5% acetic acid 로 수세(Washing) |
|
|
16. |
5% aqueous phosphotungstic acid 수세(Washing) 2번 |
각5 min |
|
17. |
0.5% acetic acid 로 수세(Washing) |
|
|
18. |
무수 알코올에서 3번 수세(Washing) |
빨리 담갔다 뺌 |
|
19. |
Safran에서 염색 |
15 min |
|
20. |
무수 알코올에서 2번 |
|
|
21. |
투명 및 봉입 |
|
Movat Pentachrome 염색 문제 해결
Alcian blue는 pH 2.5에서 사용해야 합다. 좋은 염색을 위해서 알칼리성 알코올을 완전히 제거해야만 합니다. Verhoeff 용액은 빠르게 산화되어서 매번 사용할 때 마다 새로 만들어야 합니다. 염화철(ferric chloride) 에서 탄력섬유(Elastic Fiber)가 과도하고 분별되지 않도록 주의하여야 합니다. 한두 번 담근 후 증류수(DDW)에 헹구고 현미경으로 확인합니다. 필요 시 반복하며, 탈수과정을 위해 희석된 알코올을 사용하지 말고 무수 알코올로 시작합니다. 염색 절차 동안 절편이 마르지 않도록 주의합니다.
발표자 소개

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
참조 문헌
참고 문헌
Rolls, Geoffrey. “101 Steps to Better Histology – A Practical Guide to Good Histology Practice”. Knowledge Pathway/Training Resources.
Shaikh, Imran. “Special Stains in Histopathology” Kem Hospital, 2012.
Sheehan, D. “Theory and Practice of Histotechnology.” Connective Tissue. 2nd edition, 10: 180-200.
Culling, C., et.al. Cellular Pathology Technique, edition 4. Butterworths, London, England 1985.
Wikipedia – Ammoniacal Silver, Nov 2013.
Russel, H.K. A Modification of the Movat Pentachrome Stain. Arch Pathol, 94: 187, 1972.
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.