
特殊染色‐種類・選択・手順 パートI:ムチンとグリコーゲン

「特殊染色」の定義
「特殊染色」は、従来のHE染色では、病理医や研究者が組織スライドから必要なすべての情報を得ることができない場合に用いる、多くの化学反応を用いた染色を指すために使用される用語です。「特殊染色」は一連のプロセスであり、一般に、明示したい特定の組織成分に親和性のある色素や化学物質を使用します。それらの色素や化学物質により、特定の細胞タイプ、構造、または微生物の存在/非存在を顕微鏡で見ることが可能になります。「特殊染色」は、 免疫組織化学 (IHC)や分子技術(プローブ)とは違うものであり、以前から存在していた方法ではありません。
ムチン‐概論
ムチンは炭水化物と呼ばれる複雑なグループの一員です。炭水化物は、簡単には糖類とデンプンとして定義できます。炭水化物は、単糖類、多糖類、ムコ多糖類に分けられます。ムチンはムコ多糖類で、長鎖の糖分子として全身に見られ、生命に不可欠であり、骨、軟骨、皮膚、弾性組織および膜の構造的完全性の維持に重要です。また、毛細血管と細胞の間の栄養素の流れを調節するのに役立っているので、細胞増殖に重要であり、「生命の接着剤」として知られています。
ムチンは大きく2つに分類されます:
酸性ムチン:負の電荷を帯びたムチン分子で、カルボキシル基がついた単純ムチン、または硫酸基がついた複合ムチンに分類されます。これらは消化管や気道の全体に広く見られます。
中性ムチン:酸性基がなく、電荷を持っていません。これらは胃の上皮や十二指腸のブルンナー腺にあります。中性ムチンは、十二指腸の内層を胃酸内容物から保護し、消化酵素に対してアルカリ性環境を提供することにより吸収を可能にし、腸壁と前立腺上皮を滑らかにします。
酸性ムチン‐最もよく使われる3つの色素
1) アルシアンブルー
アルシアンブルーは銅を含む塩基性の色素で、銅のために青色を呈します。色素分子は正の電荷を帯び、負のムチンに引き付けられます。アルシアンブルー溶液のpHを調整することにより、サブタイプの酸性ムチンを明示することが可能になります。
pH 2.5 – 包括的(カルボキシル基、硫酸基ともに検出可能)なムチン染色により明示されると考えられるのは次のものです:
- 結合組織や軟骨のようなカルボキシル化された(低酸性度)単純ムチン
- バレット食道の杯細胞
pH 1.0 硫酸化(高酸性度)複合ムチンを示すのは以下の場所にあります:
- 大腸杯細胞
- 気管支漿液腺
- 腺癌
通常アルシアンブルー処理でムチン陽性を示す組織の例:
- 大腸杯細胞
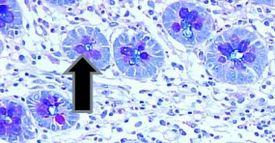
- バレット食道の杯細胞
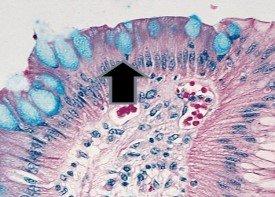
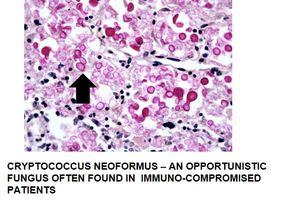
- 生物のムコイド莢膜‐クリプトコッカス
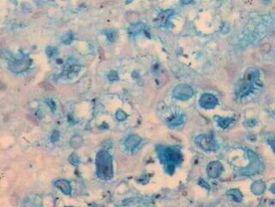
- マスト細胞顆粒‐ほとんどすべての組織に見られる免疫担当細胞で、免疫応答のセンチネルとして機能する。
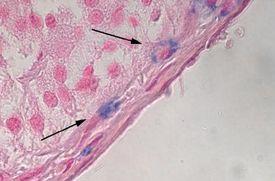
アルシアンブルーによって同定される疾患プロセスの例:
- 粘液性腫瘍
- 60%以上粘液で構成される癌は粘液性と呼ばれます
- 粘液性腫瘍は、すべての腺癌の約10~15%を占めます
- ムチン産生性と確認された腺癌
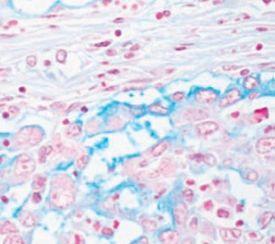
- 粘液水腫‐皮膚や他の組織に生じるムチンの異常な沈着を伴う腫れ(浮腫)の一種
- 粘液腫‐まれな心臓の良性腫瘍で、成長すると血流を妨害し、致命的となることがあります。

アルシアンブルー染色の概要:
|
組織の種類 |
組成 |
アルシアンブルー 2.5 |
アルシアンブルー 1.0 |
|
|---|---|---|---|---|
|
消化管 |
中性ムチン |
ネガティブ |
ネガティブ |
|
|
前立腺 |
中性ムチン |
ネガティブ |
ネガティブ |
|
|
杯細胞 |
酸性ムチン‐単純 |
ポジティブ |
ネガティブ |
|
|
組織間質 |
酸性ムチン‐単純 |
ポジティブ |
ネガティブ |
|
|
腺癌 |
|
ネガティブ |
ポジティブ |
|
|
軟骨、骨 |
|
ネガティブ |
ポジティブ pH 0.5 |
注:アルシアンブルーは中性ムチンを染色しません
プロセス
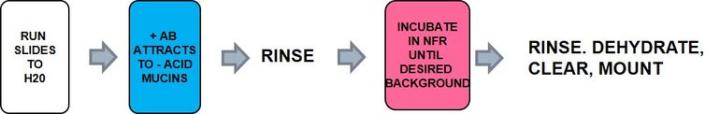
プロトコール‐インキュベーションの時間や各試薬の濃度、ステップはメーカーごとに異なる可能性があります。
|
1. |
スライドを水に浸す |
||
|
2. |
アルシアンブルー ‐ 注意して適切なpHを選択 |
30 分 |
|
|
3. |
流水でよくすすぐ |
2 分 |
|
|
4. |
ヌクレアファストレッド(ケルンエヒトロート)で対比染色 |
2 分 |
|
|
5. |
流水で短時間すすぐ |
||
|
6. |
|
アルシアンブルー染色のトラブルシューティング:
ヌクレアファストレッド(ケルンエヒトロート)は、溶液中で沈殿する傾向があり、良好な対比染色が得られない場合があるため、最良の結果を得るためには、使用前に十分に混合する必要があります。適切なpHのアルシアンブルーを使用して、偽陰性になる可能性を防いでください。
2) コロイド鉄
コロイド鉄を、酸性ムチンを識別するために使用します。コロイド鉄は、酸性ムチンに対する感度が高く、非常に少量で検出できるので、アルシアンブルー染色の代わりによく使用されます。一部の腎細胞癌および中皮腫の診断に使用されます。中皮腫は中皮(多くの内臓を覆う保護粘膜)に由来する形質転換細胞から発生するまれな型の癌です。
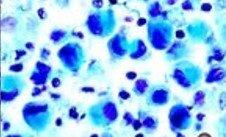
プロセス
正に帯電した鉄イオン(三価鉄)は負のムチン分子に引き付けられます。次に、付着した鉄イオンをフェロシアン化カリウム/HCL溶液で処理して、目に見える明るい青色の沈着を形成させます。
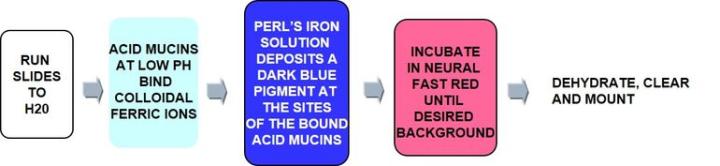
プロトーコル‐インキュベーションの時間や各試薬の濃度、ステップはメーカーごとに異なる可能性があります。
|
1. |
スライドを水に浸す |
||
|
2. |
|
12 分 |
|
|
3. |
コロイド鉄染色液で処理 |
60 分 |
|
|
4. |
|
3 分 |
|
|
5. |
もう一度12%酢酸水溶液ですすぐ |
3 分 |
|
|
6. |
フェロシアン化カリウム ‐ 塩酸溶液 |
20 分 |
|
|
7. |
流水ですすぐ |
2 分 |
|
|
8. |
ヌクレアファストレッド(ケルンエヒトロート)で対比染色 |
5 分 |
|
|
9. |
流水で短時間すすぐ |
||
|
10. |
脱水、透徹、封入 |
コロイド鉄染色のトラブルシューティング‐非特異的ヘモシデリン染色の取り扱い:
- AとBというラベルを付けた2枚の同じスライドを用意する
- プロトコール全体を通してスライドAをインキュベートする
- 一度再水和したスライドBをフェロシアン化カリウム‐HCL溶液のみでインキュベートする
- 試験組織の分析においては、スライドAで見られるスライドBの染色を無視する
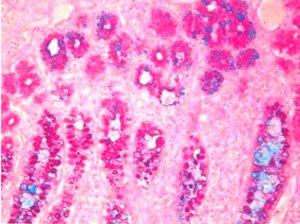
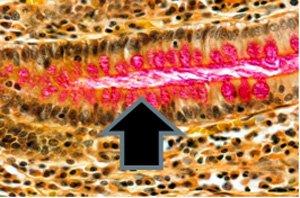
3)ムチカルミン‐上皮由来のムチンに対する非常に特異的な染色
免疫組織化学的手法が利用可能になる前は、ムチカルミン染色を使用して印環癌の存在を確認していました。印環癌はムチンを産生するまれな型の非常に悪性の腺癌です。印環癌は、印環細胞の組織学的外観を特徴とする上皮性悪性腫瘍です。
3つの方法で示された印環細胞癌:
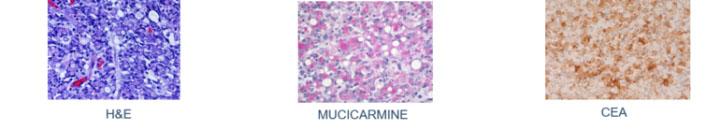
ムチカルミン染色は、ムチン陰性の扁平上皮癌とムチン陽性の腺癌を区別するためにも使用されます。
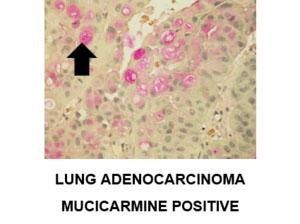
ムシカルミンによる陽性染色の追加例:
プロセス
コチニールカイガラムシの粉砕体から得られた染料であるカルミンは、 ヘマトキシリン とほとんど同じように、溶液中でアルミニウム塩と結合します(媒染と呼ばれるプロセス)。これにより、正に帯電した複合体が生成され、負の酸性ムチン分子に引き付けられます。
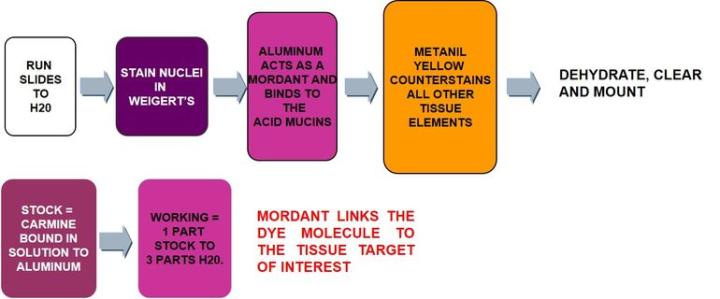
プロトコール‐インキュベーションの時間や各試薬の濃度、ステップはメーカーごとに異なる可能性があります
|
- |
スライドを水に浸す |
|
|
- |
ワイゲルトヘマトキシリン染色液(マイヤーヘマトキシリンでも可能) |
5-10 分 |
|
- |
流水ですすぐ |
|
|
- |
ムチカルミン染色液 |
20-30 分 |
|
- |
流水ですすぐ |
|
|
- |
メタニールイエロー |
1-3 分 |
|
- |
流水で短時間すすぐ |
|
|
- |
脱水、透徹、封入 |
ムシカルミン染色のトラブルシューティング:
製造元の指示に従って、ムシカルミン染色液を作製してください。使用説明書に従って忘れずに希釈し、希釈には適切な水を使用してください(蒸留水と水道水)。調整不良の溶液中に長時間置いたり、希釈していないムシカルミンで染色したりすると、期待した結果が得られません。ワイゲルトヘマトキシリン染色液は新鮮なものを使用します ‐ もしワイゲルトヘマトキシリン染色液が紫色ではなく茶色がかっている場合、それは分解されており、核は適切に染色されません。作業用のワイゲルトヘマトキシリン染色液は丸一日は持つかもしれませんが、通常一晩は持ちません。メタニールイエローは対比染色であるため、明るくしてください。
中性ムチン‐最も一般的に用いられる染色
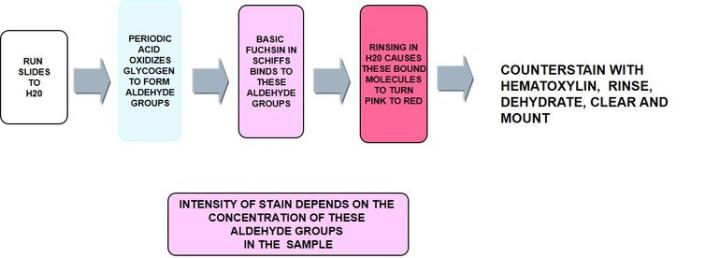
1) 過ヨウ素酸シッフ(PAS反応)
過ヨウ素酸シッフ(PAS反応)は、最も用途が広い炭水化物染色で、中性ムチンと、以下に記述するようにグリコーゲンを検出します。これは、上皮細胞の非硫酸化単純酸性ムチンを認識し、ムチン細胞の負電荷に依存しませんが、糖単位の構造に依存します。
プロセス
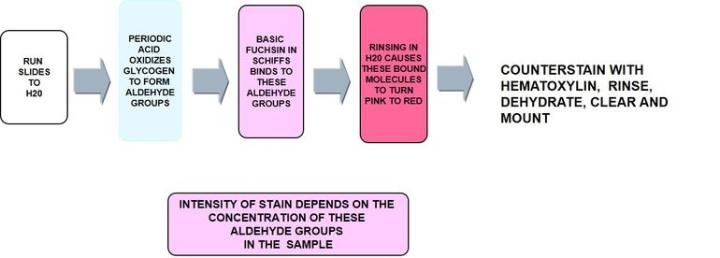
プロトコール‐インキュベーションの時間や各試薬の濃度、ステップはメーカーごとに異なる可能性があります
|
1 |
スライドを水に浸す |
|
|
2 |
0.5%過ヨウ素酸で酸化 |
5 分 |
|
3 |
シッフ試液 |
15 分 |
|
4 |
流水でよくすすぐ |
5 分 |
|
5 |
マイヤーヘマトキシリン |
1 分 |
|
6 |
流水でよくすすぐ |
1 分 |
|
7 |
脱水、透徹、封入 |
酸性ムチンと中性ムチン‐同じスライドで両方を検出する方法
1) アルシアンブルー‐PAS
プロセス
アルシアンブルーは酸性ムチンを染色し、中性ムチンはPAS陽性を染色します
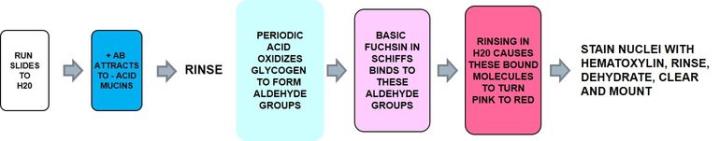
結果:
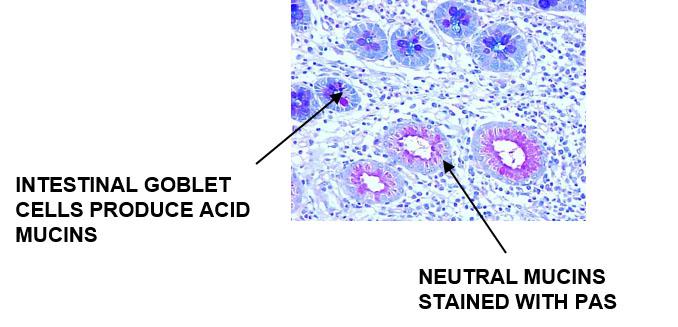
プロトコール‐インキュベーションの時間や各試薬の濃度、ステップはメーカーごとに異なる可能性があります
|
1. |
スライドを水に浸す |
|
|
2. |
アルシアンブルー |
15 分 |
|
3. |
流水でよくすすぐ |
12 分 |
|
4. |
過ヨウ素酸 |
5 分 |
|
5. |
流水でよくすすぐ |
|
|
6. |
シッフ試液 |
10 分 |
|
7. |
亜硫酸水 |
各2分、3回 |
|
8. |
流水ですすぐ |
5分 |
|
9. |
マイヤーヘマトキシリン |
5分 |
|
10. |
流水ですすぐ |
|
|
10. |
脱水、透徹、封入 |
アルシアンブルー‐PASのトラブルシューティング:
- アルシアンブルーはpH2.5のものを使用してください
- 過ヨウ素酸が新しいことを確認してください
- メーカーのガイドラインに従ってシッフ試薬を保管してください
グリコーゲン‐概論
グルコースは細胞の燃料の主な供給源です。過剰なグルコースは肝臓と筋肉に蓄えられます。この貯蔵形のグルコースはグリコーゲンと呼ばれます。体が食物から十分なグルコースを摂取しないときは、グリコーゲンを分解してグルコースを血流に放出します。
グリコーゲンを検出する方法:
過ヨウ素酸シッフ(PAS反応)は、肝臓、基底膜、膀胱・腎臓・膵臓・卵巣の腫瘍の一部、および真菌に存在するグリコーゲンを検出するために使用されます
通常PASで染色される組織の例:
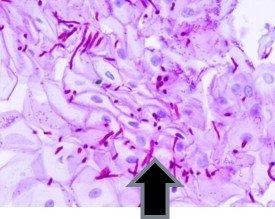
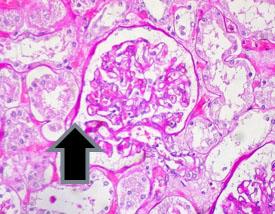
グリコーゲンの存在とその分布パターンは、次のような疾患で重要です:
-
肝型糖原病
-
ポンペ病‐グリコーゲンの蓄積は、全身に進行性の筋力低下(ミオパチー)を引き起こし、さまざまな体組織、特に心臓、骨格筋、肝臓、神経系に影響を与えます
-
横紋筋肉腫‐結合組織癌
-
中皮腫
プロセス
PASのトラブルシューティング:
過ヨウ素酸が薄くなっておらず強度があることが重要です。適切な保管方法については、シッフ試薬の添付文書をお読みください。
グリコーゲンを検出する方法:
PASD(ジアスターゼを含む過ヨウ素酸シッフ)
ジアスターゼ(αアミラーゼおよびβアミラーゼ抽出物を含む麦芽抽出物)は、デンプンと糖の変換を助ける酵素(ジアスターゼ)です。このジアスターゼはグリコーゲンをより小さな糖分子に分解し、糖分子はその後洗い流されます。
ジアスターゼ消化を実行し、グリコーゲンを他のPAS陽性分子から区別する方法:
- 2つの同一の組織切片を、各スライドに1つずつ置きます
- スライドAを水または緩衝液で処理します。
- スライドBをジアスターゼ(α-アミラーゼ0.25 gを50 mlの蒸留水に溶解)で処理します
- 両方のスライドを上記のプロトコールによりPASで染色します
- 脱水、透徹、封入してください
結果:
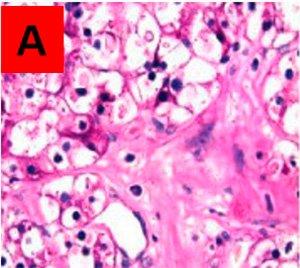
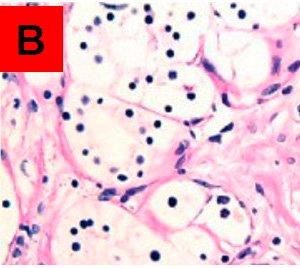
未処理のスライドAでPAS陽性、処理済みのスライドBでPAS陰性である領域が、真のグリコーゲンであると考えられます。両方のスライドでPAS陽性のものは、酵素によって分解されない他のPAS陽性物質です。
PASDのトラブルシューティング:
過ヨウ素酸が新しく、シッフ試薬の溶液が安定していることを確認してください。使用している酵素が正しいことを確認してください(重要です)。プロトコールの仕様書に従って酵素を希釈してください。消化後に消えるPAS陽性がグリコーゲンであることを覚えておいてください。この場合、陰性であることが陽性を意味します。
ヒント:市販の適切な酵素がない場合、ヒトの唾液はグリコーゲンを分解する優れた消化酵素ですので、ご自分の唾液を使用していただいて結構です。
この記事の原文は こちら
About the presenter

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
References
Rolls, Geoffrey. “101 Steps to Better Histology – A Practical Guide to Good Histology Practice”. Knowledge Pathway, Training Resources.
Dorst, Dick. “The Role of Mucopolysaccharides in Good Health.” Aquaculture, INC., 2012.
Shaikh, Imran. "Special Stains in Histopathology” Kem Hospital, 2012.
Ellis, Roy. “Alcian Blue and PAS Staining Protocols.” IMVS Division of Pathology, The Queen Elizabeth Hospital, Woodville, South Australia.
Mowry, RW. J. Histochem. Cytochem., 4, 407, 1956.
Myers, Russell. “Special Stain Techniques for The Evaluation of Mucins.” Knowledge Pathway, Tutorials.
Pernick, Nat . “Mucins.” Pathology Outlines Jan 26, 2016.
Sheehan, D. . “Theory and Practice of Histotechnology.” Carbohydrates. 2nd edition, 9: 159-178.
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.