
Tinciones especiales: ¿cuál, cómo y por qué? Parte II: Tejido conjuntivo

Definición
Definir "tinción especial"
"Tinción" especial es un término utilizado para referirse a muchas técnicas de tinción alternativas que se utilizan cuando la H&E tradicional no proporciona toda la información que el patólogo o investigador necesita de una preparación de tejido. "Las tinciones" especiales son procesos que generalmente emplean un tinte o un producto químico que tiene una afinidad con el componente tisular particular que se debe mostrar. Permiten ver microscópicamente la presencia/ausencia de ciertos tipos de células, estructuras y/o microorganismos. Las "tinciones especiales" no son lo mismo que las técnicas inmunohistoquímicas (IHC) y/o moleculares (sondas).
Tejido conjuntivo - Introducción
El tejido conjuntivo ayuda al cuerpo proporcionando una matriz que conecta y une las células y los órganos. Hay tres tipos de tejido conectivo en el cuerpo.
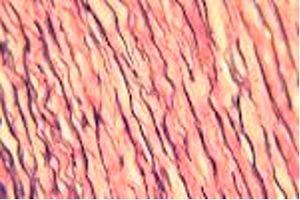
El colágeno es una proteína fuerte y es un componente principal de los ligamentos y tendones. También es responsable de la elasticidad de la piel y es el tipo más visible que se puede visualizar con una tinción H&E.
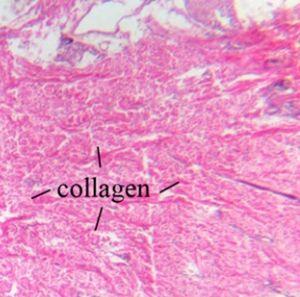
Las fibras elásticas se encuentran en la piel y las paredes de los vasos sanguíneos. Están compuestas de elastina, una proteína que es flexible y permite que muchos tejidos del cuerpo recuperen su forma después de estirarse o contraerse, y no se visualizan mediante una H&E.
Las fibras reticulares están compuestas de colágeno y forman una delicada estructura alrededor de las fibras nerviosas, los adipocitos, los ganglios linfáticos y las fibras musculares lisas y esqueléticas. Tampoco se visualizan mediante una H&E.
Las tinciones utilizadas con más frecuencia para mostrar el tejido conjuntivo
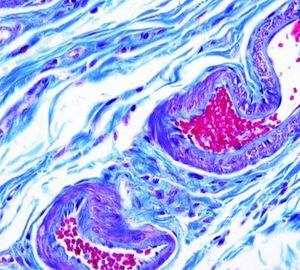
Tinción tricrómica: Masson
Se utilizan tres tintes para teñir selectivamente, incluidos músculos (rojo), fibras de colágeno (azul), eritrocitos (rojo) y núcleos (negro).
Los tintes se utilizan para teñir biopsias hepáticas con el fin de determinar el grado de fibrosis como en la cirrosis, así como biopsias renales para acentuar la membrana basal y evidenciar depósitos inmunes. Los tintes también se utilizan para diferenciar entre músculo liso y colágeno en tumores y verificar el aumento de colágeno.
El proceso
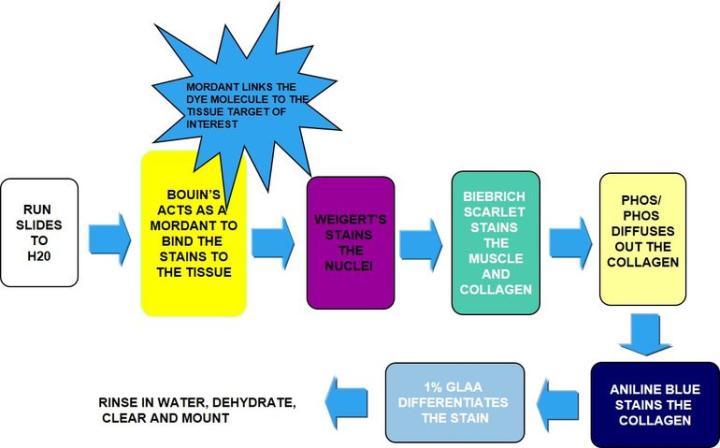
Los resultados

El Protocolo: los tiempos de incubación pueden variar según las directrices el fabricante
|
1. |
Poner las preparaciones en agua |
|
|
2. |
Incubación en solución de Bouin: actúa como mordiente para unir el colorante al tejido. |
|
|
normalmente durante la noche |
|
|
10-15 minutos |
|
|
3. |
Enjuagar bien con agua corriente para eliminar todos los restos de solución de Bouin |
|
|
4. |
Hematoxilina de Weigert |
5-10 mins |
|
5. |
Enjuagar con agua corriente |
5 mins |
|
6. |
Escarlata de Biebrich |
15 mins |
|
7. |
Enjuagar con agua corriente |
|
|
8. |
Ácido fosfotúngstico / fosfomolíbdico |
15 mins |
|
9. |
Directamente a azul de anilina (sin enjuagar) |
5 mins |
|
10. |
Directamente a ácido acético glacial al 1 % |
1-3 mins |
|
11. |
Enjuagar con agua corriente |
|
|
12. |
Deshidratar, aclarar y montar |
Solución de problemas de la tinción ticrómica
Es esencial utilizar una buena solución de Bouin con tiempos de incubación adecuados a la temperatura utilizada. Complete la diferenciación con ácido fosfomolibdico-fosfotúngstico del colágeno hasta eliminar todo el rojo. Si el rojo muscular es pálido, compruebe la viabilidad del escarlata de Bouin y/o Biebrich. Si el colágeno es demasiado pálido, reduzca el tiempo de incubación en GLAA al 1 %. Núcleos: negro
Tinción tricrómica de Gomori en un solo paso
Una solución lo tiñe todo: músculo, fibras de colágeno, fibrina y eritrocitos. Hay dos formulaciones disponibles: azul, para aquellos que prefieren el azul de colágeno como en Masson, y el verde, para aquellos que prefieren el verde de colágeno, y todos los demás resultados son similares a los de Masson.
El proceso
Los resultados
El protocolo
Los tiempos de incubación pueden variar según las directrices del fabricante.
|
1. |
Poner las preparaciones en agua |
|
|
2. |
Incubación en solución de Bouin: actúa como mordiente para unir el colorante al tejido. |
|
|
normalmente durante la noche |
|
|
10-15 mins |
|
|
3. |
Enjuague bien con agua corriente para eliminar todos los restos de solución de Bouin |
|
|
4. |
Hematoxilina de Weigert |
5-10 mins |
|
5. |
Enjuagar con agua corriente |
5 mins |
|
6. |
Solución azul/verde de un solo paso |
15 mins |
|
7. |
Directamente a ácido acético glacial al 1 % |
1 min |
|
8. |
Enjuagar con agua corriente |
|
|
9. |
Deshidratar, aclarar y montar |
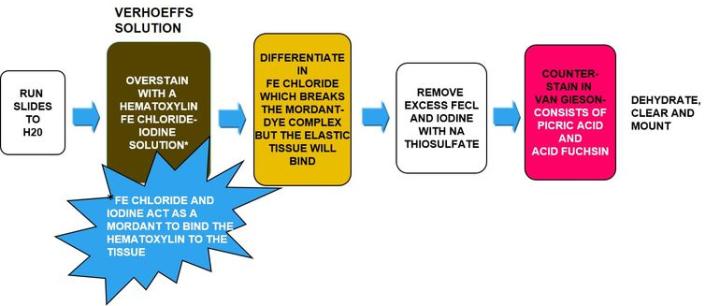
Tinción de Verhoeff-Van Gieson de fibras elásticas
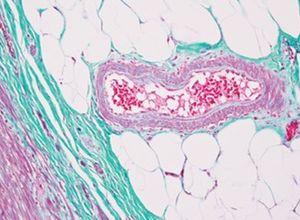
La tinción de Verhoeff-Van Gieson de fibras elásticas se utiliza para identificar la atrofia del tejido elástico como en el enfisema, la evidencia de enfermedades vasculares (arteriosclerosis) y la invasión de tumores en los vasos.
El proceso
Los resultados
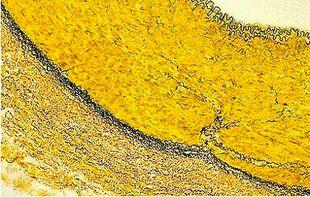
El protocolo
Los tiempos de incubación pueden variar según las directrices del fabricante.
|
1. |
Poner las preparaciones en agua |
|
|
2. |
Tinción de Verhoeff elástica: solución de trabajo (según el fabricante) |
15 min |
|
3. |
Enjuagar bien con agua corriente |
|
|
4. |
Diferenciar en cloruro férrico al 2 % |
1-2 mins |
|
5. |
Enjuagar con agua corriente |
5-10 mins |
|
6. |
Tiosulfato sódico al 5 % |
1 min |
|
7. |
Enjuagar con agua corriente |
|
|
8. |
Contratinción en solución de van Gieson |
30 sec -1min |
|
9. |
Deshidratar rápidamente en alcohol de 95 % (dos cambios) y a continuación en alcohol absoluto (100%) |
|
|
10. |
Aclarar y montar |
Solución de problemas de la tinción elástica:
La solución de Verhoeff debe ser fresca en cada uso debido a la rápida oxidación. No diferencie demasiado en el cloruro férrico, ya que las moléculas del colorante se ven atraídas a este igual que a las moléculas de tejido a las que están unidas y se desunirán del tejido fácilmente y tendrá que comenzar de nuevo. Incube durante unos segundos y luego enjuague rápidamente y mire en el microscopio para buscar las fibras de tejido elásticas. Cuando sean negras y se diferencien fácilmente del colágeno y otros tipos de tejido, detenga el proceso.
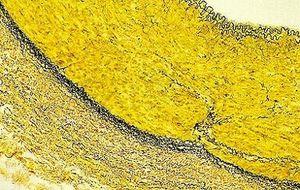
Asimismo, no incube demasiado tiempo en van Gieson ya que el ácido pícrico en solución continuará diferenciando la hematoxilina unida.
Fibra de reticulina de Gomori
Las fibras de reticulina sustentan al cuerpo y son comunes en el hígado, el bazo y los riñones. Los patrones característicos de la reticulina pueden ayudar a diagnosticar cirrosis del hígado, fibrosis temprana en la médula ósea, tumores como hemangiosarcomas (tumores de las células que recubren los vasos sanguíneos), tumores fibroblásticos y rabdomiosarcomas (tumores de los músculos adheridos al hueso). También pueden ayudar a diagnosticar tumores epiteliales frente a no epiteliales.
Las manchas de reticulina utilizan plata y dependen de las propiedades argirófilas de las fibras. Las células argirófilas pueden adsorber plata pero no pueden reducirla. Adsorber hace referencia al proceso basado en la superficie; en cambio, absorber se refiere a la permeación a través del tejido. Las células argirófilas necesitan un reductor / revelador para convertir las sales de plata invisibles en una plata metálica visible.
El proceso
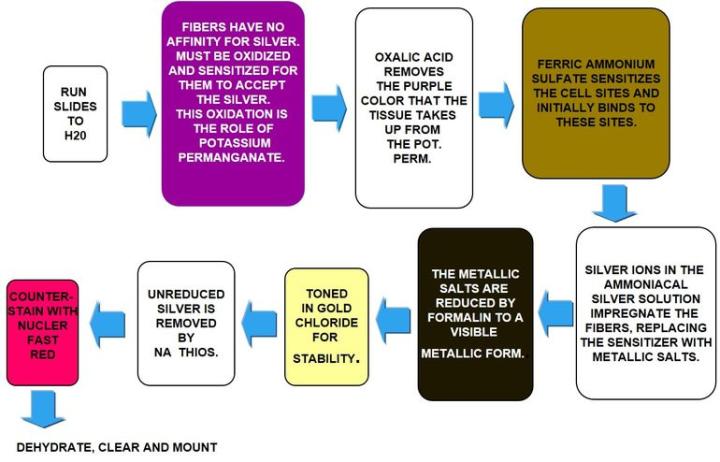
Los resultados
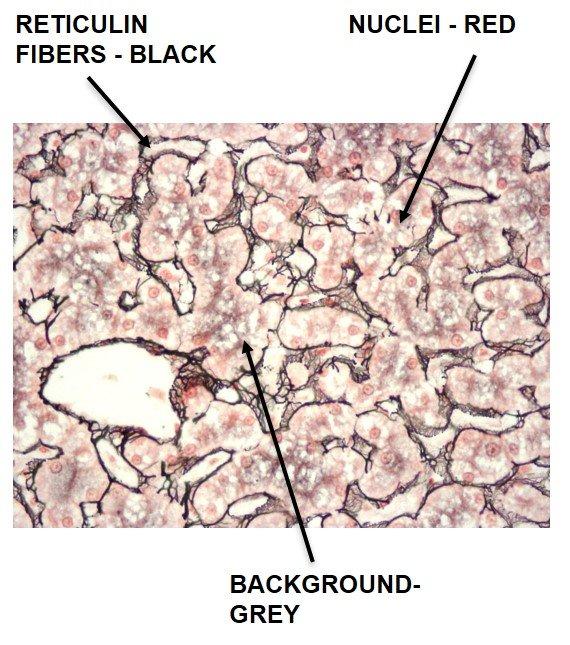
El protocolo
|
1. |
Poner las preparaciones en agua |
|
|
2. |
Oxidar en permanganato potásico |
10 min |
|
3. |
Enjuagar bien con agua corriente |
3 mins |
|
4. |
Ácido oxálico |
1 min |
|
5. |
Enjuagar bien con agua corriente |
2 mins |
|
6. |
Sensibilizar en sulfato de amonio férrico |
15 mins |
|
7. |
Enjuagar con agua destilada |
2 mins |
|
8. |
Impregnar en plata amoniacal |
2 mins |
|
9. |
Enjuagar con agua destilada |
1 min |
|
10. |
Revelar en formalina no tamponada al 20 % |
1 min |
|
11. |
Enjuagar bien con agua corriente |
2 mins |
|
12. |
Matizar en cloruro de oro al 0,1 % |
3-5 mins |
|
13. |
Enjuagar con agua |
1 min |
|
14. |
Tiosulfato sódico al 5 % |
1 min |
|
15. |
Aclarar con agua |
1 min |
|
16. |
Contrastar con rojo nuclear sólido |
3-5 mins |
|
17. |
Enjuagar brevemente en agua |
15 sec |
|
18. |
Deshidratar, aclarar y montar |
Solución de problemas de la reticulina de Gomori:
La solución de plata debe prepararse con agua destilada y en recipientes limpios (no es necesario limpiarla con ácido). Vaya con cuidado al preparar la solución de plata. El uso de hidróxido de amonio viejo y sin amoníaco puede hacer que la solución falle. No utilice un exceso de hidróxido amónico para eliminar la solución de hidróxido de plata/sodio. El exceso de hidróxido amónico dará lugar a una tinción débil.
Cómo hacer solución amoniacal de plata:
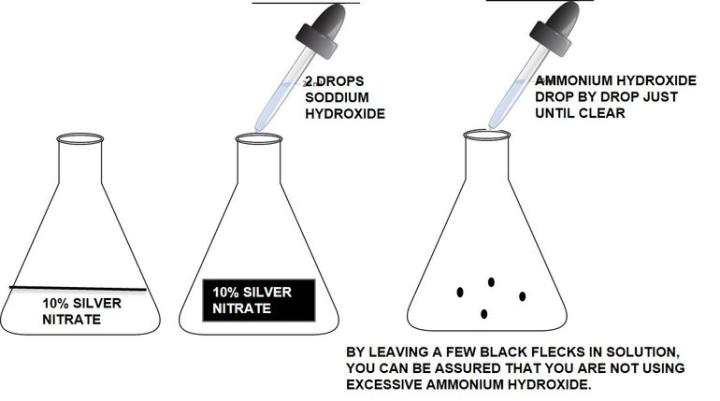
Cómo mostrar el colágeno, las fibras elásticas, las fibras reticulares, los núcleos y el músculo con un solo procedimiento
Movat Pentachrome
Movat Pentachrome es una tinción de tejido super conectivo. Se utiliza para estudiar el tejido cardíaco, los vasos sanguíneos y las enfermedades vasculares y pulmonares. Debido a la excelente diferenciación de colágeno, elástico, fibrina y fibras musculares, el Movat puede revelar cambios sutiles que las tinciones especiales de rutina y normales no muestran.
El proceso
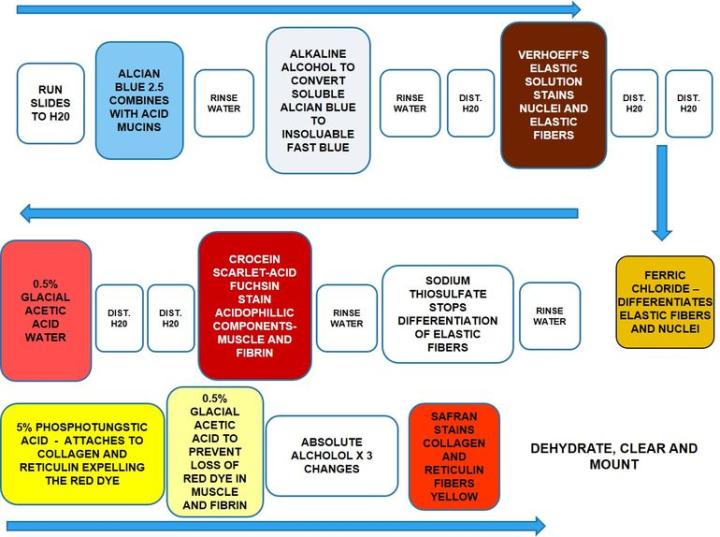
Los resultados

El protocolo
Los tiempos de incubación y la secuencia de reactivos pueden variar según el fabricante, pero los resultados son similares.
|
1. |
Poner las preparaciones en agua |
|
|
2. |
Azul alcián |
20 min |
|
3. |
Enjuagar bien con agua corriente |
5 min |
|
4. |
Alcohol alcalino |
60 min |
|
5. |
Enjuagar bien con agua corriente |
10 min |
|
6. |
Enjuague con agua destilada |
|
|
7. |
Solución de Verhoeff elástica |
Entre 12 y 15 min |
|
8. |
Agua destilada x 2 |
|
|
9. |
Cloruro férrico |
De 2 a 3 inmersiones |
|
10. |
Enjuague con agua destilada |
|
|
11. |
Tiosulfato sódico |
1 min |
|
12. |
Enjuague bien con agua corriente |
5 min |
|
13. |
Croceína escarlata - fucsina ácida |
Entre 1:30 y 3 min |
|
14. |
Agua destilada x 2 |
|
|
15. |
Agua con ácido acético al 0.5 % |
|
|
16. |
Ácido fosfotúngstico acuoso al 5 % x 2 |
5 min cada uno |
|
17. |
Agua con ácido acético al 0,5 % |
|
|
18. |
Alcohol absoluto x 3 |
Inmersiones rápidas |
|
19. |
Safranina |
15 min |
|
20. |
Alcohol absoluto x 2 |
|
|
21. |
Aclarar y montar |
|
Solución de problemas de la tinción pentacrómica de Movat
El azul alcián debe utilizarse con pH de 2,5. La eliminación completa del alcohol alcalino es esencial para una buena tinción. La solución de Verhoeff debe renovarse cada vez que se utilice, ya que se oxida rápidamente. Tenga cuidado de no diferenciar en exceso las fibras elásticas en el cloruro férrico. Sumerja una o dos veces y luego enjuague en agua destilada y compruebe al microscopio. Repita según sea necesario. No utilice alcoholes graduados para deshidratar, empiece con alcohol absoluto. No permita que las secciones se sequen durante el procedimiento de tinción.
About the presenter

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
Referencias
Bibliografía
Geoffrey Rolls. “101 Steps to Better Histology – A Practical Guide to Good Histology Practice”. Líderes de patología / artículos
Shaikh, Dr. Imran, “Special Stains in Histopathology.” Kem Hospital, 2012
Sheehan and Hrapchak, “Theory And Practice Of Histotechnology” Connective Tissue 2nd Edition 10: 180-200.
Culling, CFA, Allison R.T, Barr W.T., (1985) Cellular Pathology Technique, ed. 4. Butterworths, London, England.
Wikipedia – Ammoniacal Silver, Nov, 2013.
Russel, H.K.: A Modification of the Movat Pentachrome Stain. Arch Pathol, 94: 187, 1972
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.