
正常和病理性皮肤中的因子 XIIIa 表达


FXIIIa 是一种血液和细胞内产生的凝血因子,在各种类型的细胞中广泛表达。 它对于凝血级联的最后阶段至关重要,并且对于伤口愈合和修复机制也很重要。 它还在胚胎着床的血管发生中发挥作用。 在正常皮肤中,它在被称为“皮肤树突状细胞”的细胞中广泛表达,该细胞来自单核细胞/巨噬细胞或成纤维细胞系。 皮肤树突状细胞主要位于真皮-表皮交界处的乳头状真皮层中(但通常不存在于表皮内),它们还与皮肤附属器相关。 可在一系列皮肤炎症性疾病(包括扁平苔藓和银屑病)中观察到 FXIIIa 阳性细胞数量升高。 在肿瘤病理学中,FXIIIa 的主要应用是帮助区分皮肤纤维瘤 (DF) 和其他纤维组织细胞实体之间的免疫表型差异,差异最显著的是隆突性皮肤纤维肉瘤 (DFSP)。
介绍
因子 XIIIa 是一种凝血转谷氨酰胺酶前体1, 由于其与凝血酶和钙2+ 的相互作用,使其成为凝血级联最后阶段的活化组分。 FXIIIa 在纤维蛋白稳定中发挥关键作用,纤维蛋白稳定缺陷是由于先天性 FXIII 缺乏症(一种常染色体隐性遗传疾病)的严重出血表现所致。 该酶的血浆形式是一种由配对的 A 和 B 亚基 (A2B2) 组成的异四聚体。 该酶的组织或细胞形式,由于蛋白质缺乏 B 亚基,因此结构上是一种 A 亚基 (A2) 的同源二聚体。 通过遗传学研究分别绘制了 A 和 B 亚基的基因编码,分别位于染色体 6p24–25 和 1q31–32.1。 使用胎盘组织进行的人因子 XIIIa cDNA 编码研究表明,分离的因子 XIIIa cDNA 由 3905 个碱基对组成,其编码由 732 个氨基酸组成的蛋白质2。骨髓来源细胞被认为是血浆 FXIII 中 A 亚基合成的主要部位,此外还包括肝脏中的肝细胞。 血浆 FXIII 的 B 亚基在肝脏中合成。
由于 FXIII 在凝血块形成中具有功能稳态作用,其在伤口愈合3和胚胎着床过程4(涉及血管生成途径5)中发挥重要作用。 对于伤口愈合,认为 FXIIIa 是在修复过程中降低血管内皮通透性的核心因素,并且是治疗血管通透性增加疾病的潜在新策略,尤其是慢性静脉功能不全引起的糖尿病伤口。 在胚胎着床方面,认为 FXIII 有促血管生成的特性,这对维持健康妊娠至关重要。
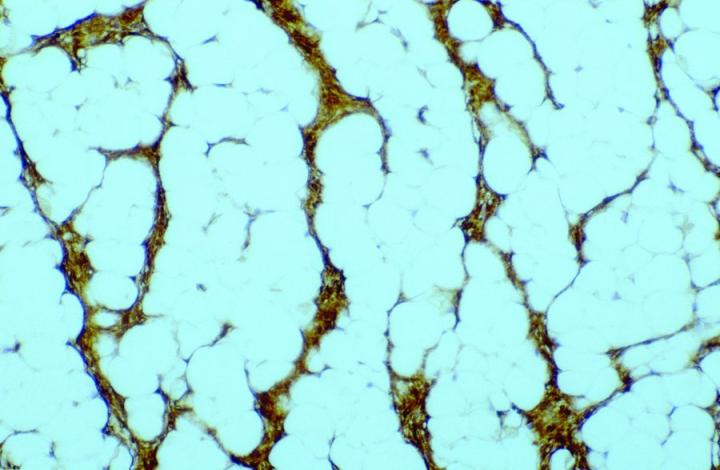
自 20 世纪 80 年代后期以来,已有抗体研究证实组织切片中存在 FXIIIa,其分别来自 Cerio 和 Headington 发表的开创性论文6。其在正常组织中分布广泛,Derrick 等人的论文7发现,在评估的所有类型器官(包括皮肤、食管、胃、小肠、大肠、膀胱、肺、肾、肝、脾、睾丸和甲状腺)中均存在 FXIIIa 阳性细胞。 根据作者的经验,FXIIIa 阳性细胞可见于更广泛的组织类型中,尤其是具有任何包裹性淋巴结构的组织,明显可见于周围结缔组织中,或渗透到此类组织(尤其是窦内衬细胞)中。 脂肪小叶间隔中可见高水平。 然而,在正常情况下,可在皮肤和黏膜组织(胃肠道和膀胱)中观察到 FXIIIa 阳性细胞增多,而肝、甲状腺、睾丸和脾等部位的数量相对较低。 重要的原因是,这些组织中的 FXIIIa 细胞数量增加表明这些细胞在免疫应答中具有重要作用。 在皮肤中,阳性细胞的分布局限于真皮,在真皮-表皮交界处的乳头状真皮层(图 1)以及附属器周围(特别是毛囊皮脂腺单位)和血管周围的疏松网状结缔组织中可见大量阳性细胞8。
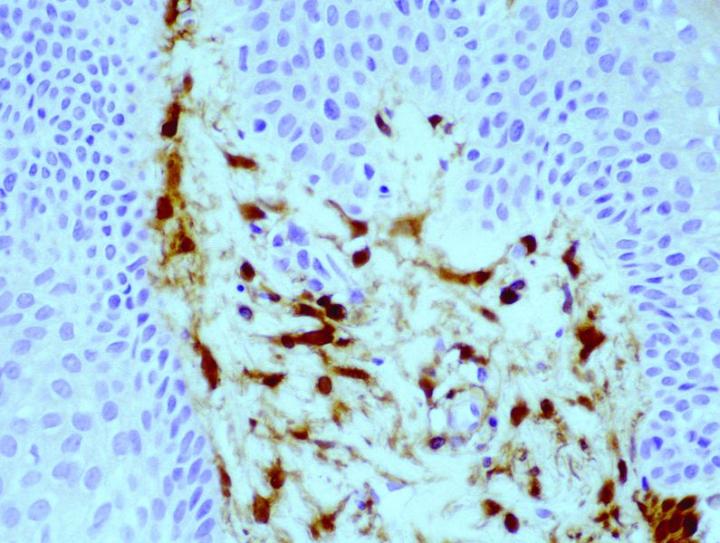
抗原表位似乎主要位于细胞质,也有膜标记的报告8。FXIIIa 细胞似乎具有不同的结构表现,具体取决于细胞的位置。 在皮肤的真皮-表皮交界处,它们表现为大树突状细胞,带有突出的细胞体和逐渐变小的细胞凸起,大部分均朝向表皮。 相反,位于较深处真皮层的细胞较窄,数量更多且排列更加紧密,树突状凸起不太明显。 术语“皮肤树突状细胞”正是来源自这些细胞的特征性外观,这是一种描述性定义,由 Headington 首创9。
这些骨髓来源细胞具有与其他抗原呈递细胞相似的特定组织酶学和免疫组织化学特征,然而,它们与朗格汉斯细胞差异很大,实际上不表达 CD1a,并且不像朗格汉斯细胞那样具有吞噬作用6。初步研究表明,皮肤树突状细胞并非来自成纤维细胞系6 & 8。此外,纤维胶原性皮肤病中的 FXIIIa 阴性标记再次肯定了这一早期观点8。相反,Nemeth 等人10报告称鼻部纤维性丘疹、获得性指(趾)部纤维角化瘤、血管纤维瘤和口腔纤维瘤中存在 FXIIIa 阳性树突状成纤维细胞。 这项研究的观察结果表明,FXIIIa 可能是这些肿瘤的生长因子,或在非特定刺激的作用下,FXIIIa 过度生成导致这些肿瘤发生。 此外,基于作者的经验,经常可在任何侵袭性皮肤肿瘤基底或周围观察到 FXIIIa 阳性细胞数量增加,并且常规巨噬细胞标志物(如 CD68)通常呈阴性。
然而,明显可见这些 FXIIIa 阳性细胞确实与单核细胞/巨噬细胞系拥有某些共同的细胞表面标志物(OKM5+、Mo1+、Mono1+ 和 Leu M3+)。 最近在人单核细胞长期培养物中进行的 FXIIIa 基因表达和蛋白质生成研究中,诱导经典或替代活化途径,并在单细胞水平采用定量 RT-PCR 和荧光图像分析,结果发现在两种激活途径中,FXIIIa 的 mRNA 和蛋白质水平表达均呈反向调节。 Torocsik 等人11 的结论是 FXIIIa 表达是替代激活巨噬细胞的一个标志物,而单核细胞衍生的巨噬细胞中不存在 FXIIIa 是其激活状态的一种指标。
皮肤疾病中广泛存在的 FXIIIa 阳性细胞可分为炎症性表达和肿瘤病理性表达。 就炎症性 FXIIIa 表达而言,在诸如棘细胞层水肿性皮炎和银屑病等疾病条件下 FXIIIa 表达升高6, 8。在急性和慢性移植物抗宿主病 (GVHD) 中 FXIIIa 阳性细胞表达升高12,一份报告表明急性(下降)和慢性(升高)GVHD 之间存在差异13。在大多数情况下,也检测到朗格汉斯细胞 (CD1a) 数量增加。 已有关于慢性斑块型银屑病患者中 FXIIIa 阳性细胞以及其他炎症细胞迁移到表皮室的报道8,再次支持了这些细胞在皮肤内具有抗原呈递细胞 (APC) 作用的观点。
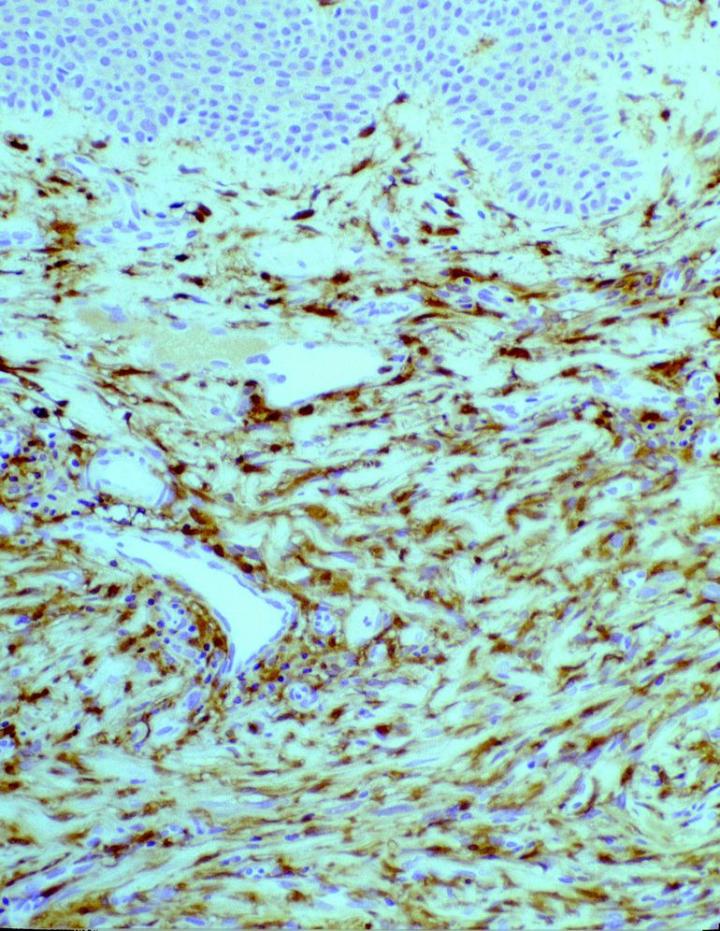
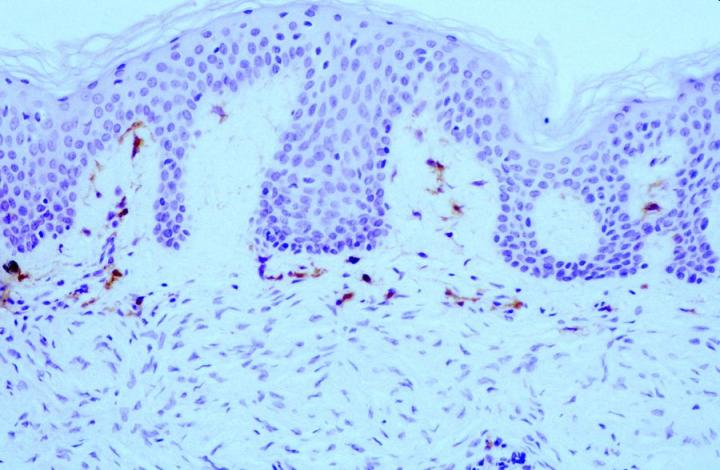
在某些皮肤间质瘤中发现了肿瘤病理性 FXIIIa 表达。 Jones 等人14和 Cerio 等人15 发表的早期报告表明,上皮样细胞组织细胞瘤和皮肤纤维瘤中 FXIIIa 升高(图 2 和 3)。
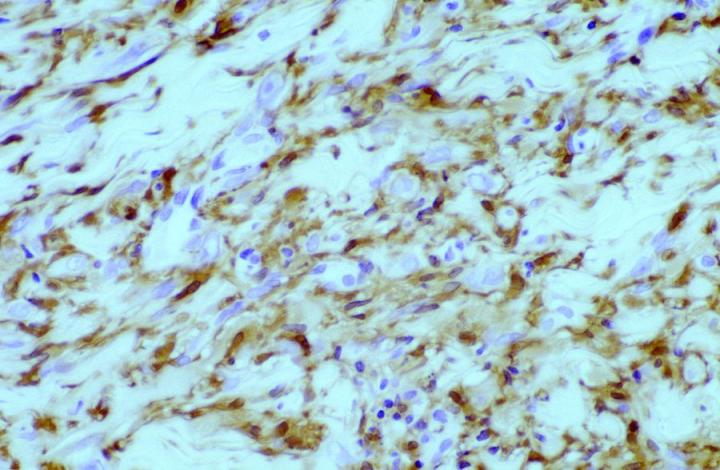
大约 50% 的组成性肿瘤细胞群在两篇论文中均呈阳性。 注意到越是病灶中心,标记越弱。 这一观察结果对于区分皮肤纤维瘤(DF)与隆突性皮肤纤维肉瘤 (DFSP) 来说非常有用。 DF 和 DFSP 的组织学表现变异很大,鉴别诊断可能很困难。 然而,DFSP 的免疫表型为 CD34 阳性(图 4 和 5),而皮肤纤维瘤表达 FXIIIa。
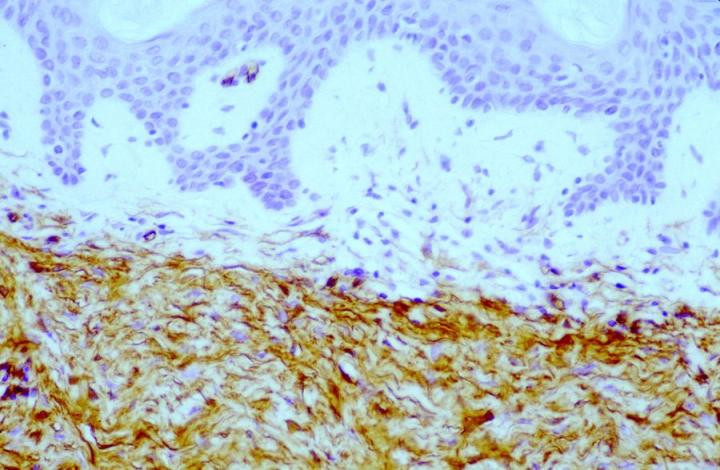
可以看到 DFSP 内存在斑片状 FXIIIa 标记,但在大多数情况下,阳性细胞实际上被嵌入非肿瘤性皮肤树突状细胞或围绕在浸润性肿瘤细胞周围(图 6)16。基于作者的经验,在某些情况下,在 DF 中也可观察到局灶性 CD34 标记,但其意义尚不清楚。
DF 中 FXIIIa 阳性细胞的免疫电镜检查显示,这些细胞与真皮树突状细胞相似,在这些细胞中,它们具有中等至大量粗面内质网,不同比例的脂滴和/或肌束或肌丝17 。还有相邻细胞之间黄斑样粘附连接的证据。 恶性纤维组织细胞瘤 (MFH) 研究表明,细胞中存在不同程度的 FXIIIa 表达。 由于这些肿瘤具有广范的组织学表现,它们都是纺锤体状成纤维细胞样细胞、未分化细胞和组织细胞或组织细胞样细胞的变异体,FXIIIa 阳性细胞存在不同水平的纤维组织细胞分化,实际上它们是纤维组织细胞前体18。
FXIIIa 也广泛表达于一系列属于非朗格汉斯细胞组织细胞增多症的肿瘤中,例如播散性黄色瘤和黄色肉芽肿19, 20。
此外,已有关于神经鞘黏液瘤细胞中 FXIIIa 阳性的报告21,这是一种相对罕见的良性皮肤肿瘤,常见于年轻成人的头颈部。 另有关于皮肤颗粒细胞瘤中观察到 FXIIIa 阳性细胞的报告22。根据免疫组织化学和电子显微镜研究,大多数皮肤颗粒细胞瘤来源自 Schwann 细胞。 皮肤颗粒细胞瘤中存在 FXIIIa 阳性细胞表明这些肿瘤是Schwann细胞瘤中的一种例外情况。
卡波西肉瘤纺锤体状细胞中的 FXIIIa 表达可能有一定的意义。 卡波西肉瘤是一种肿瘤,通常为多灶性,累及多个器官,但更常累及皮肤。 可能是因为皮肤树突状细胞的存在对于这种特定疾病的血管增生反应很重要23。
About the presenters

Guy Orchard is a Consultant Grade Biomedical Scientist and Laboratory Manager at Viapath, St John's Institute of Dermatology, London. He has been a council member for the Institute of Biomedical Science (IBMS) and is currently a specialist advisor for cellular pathology and the Deputy Chief Examiner for Cellular Pathology for the IBMS. In 2015, Guy was awarded the Leica Leadership Award for Teaching by the National Society for Histotechnologists.”

Catherine Stefanato is a Dermatopathology Consultant in the Department of Dermatology at St. John's Institute of Dermatology, London, UK. Dr. Stefanato completed her residency training in Dermatology at the Catholic University of the Sacred Heart in Rome, Italy. She undertook residency training in Anatomic Pathology at Yale University School of Medicine (USA), followed by Fellowship training in Dermatology at the Boston University School of Medicine, where she also worked as a Consultant Dermatopathologist and Assistant Professor of Dermatology and Pathology. Dr. Stefanato is a Diplomate of the American Boards of both Anatomic Pathology and Dermatology.
References
- Muszbek l, Adany R, Mikkola H. Novel aspects of blood coagulation factor XIII. I. Structure, distribution, activation, and function. Crit Rev Clin Lab Sci 1996; 33 (5): 357–421.
- Grundmann U, Amann E, Zettlmeissi G, Kupper HA. Characterization of cDNA coding for human factor XIIIa. Proc Natl Acad Sci USA 1986; 83 (21): 8024–8.
- Wozniak G, Noll T. Factor XIII and wound healing. Hamostaseologie 2002; 22 (1): 59–62.
- Tosetto A, Castaman G, Rodeghiero F. Acquired plasma factor XIII deficiencies. Haematologica 1993; 78 (6 Suppl): 5–10.
- Inbal A, Dardik R. Role of coagulation factor XIII (FXIII) in angiogenesis and tissue repair. Pathophysiol Haemost Thromb 2006; 35 (1–2): 162–5.
- Cerio R, Griffiths CE, Cooper KD, Nickoloff BJ, Headington JT. Characterization of factor XIIIa positive dermal dendritic cells in normal and inflamed skin. Br J Dermatol 1989; 121 (4): 421–31.
- Derrick EK, Barker JN, Khan A, Price ML, Macdonald DM. The tissue distribution of factor XIIIa positive cells. Histopathology. 1993; 22 (2): 157–162.
- Cerio R, Spaull J, Oliver GF, Jones WE. A study of factor XIIIa and MAC 387 immunolabeling in normal and pathological skin. Am J Dermatopathol 1990; 12 (3): 221–233.
- Headington JT. The dermal dendrocyte. Adv Dermatol 1986; 1: 159–171.
- Nemeth AJ, Penneys NS. Factor XIIIa is expressed by fibroblasts in fibrovascular tumors. J Cutan Pathol 1989; 16 (5): 266–71.
- Torocsik D, Bardos H, Nagy L, Adany R. Identification of factor XIII-A as a marker of alternative macrophage activation. Cell Mol Life Sci 2005; 62 (18): 2132–9.
- Yoo YH, Park BS, Whitaker-Menezes D, Korngold R, Murphy GF. Dermal dendrocytes participate in the cellular pathology of experimental acute graft-versus-host disease. J Cutan Pathol 1998; 25 (8): 426–34.
- Deguchi M, Aiba S, Ohtani H, Nagura H, Tagami H. Comparison of the distribution and numbers of antigen-presenting cells among T-lymphocyte-mediated dermatoses: CD1a+, factor XIIIa+, and CD68+ cells in eczematous dermatitis, psoriasis, lichen planus and graft- versu s_host disease. Arch Dermatol Res 2002;294(7):297-302.
- Jones EW, Cerio R, Smith NP. Epithelioid cell histiocytoma: a new entity. Br J Dermatol 1989; 120 (2): 185–95.
- Cerio R, Spaull J, Jones EW. Histiocytoma cutis: a tumour of dermal dendrocytes (dermal dendrocytoma). Br J Dermatol 1989; 120 (2): 197–206.
- Goldblum JR, Tuthill RJ. CD34 and factor-XIIIa immunoreactivity in dermatofibrosarcoma protuberans and dermatofibroma. Am J Dermatopathol 1997; 19 (2): 147–53.
- Song Y, Sakamoto F, Ito M. Characterization of factor XIIIa+ dendritic cells in dermatofibroma: Immunohistochemical, electron and immunoelectron microscopical observations. J Dermatol Sci 2005; 39 (2): 89–96.
- Nemes Z, Thomaszy V. Factor XIIIa and the classic histiocytic markers in malignant fibrous histiocytoma: a comparative immunohistochemical study. Hum Pathol 1988; 19 (7): 822–9.
- Zelger B, Cerio R, Orchard G, Fritsch P, Wilson-Jones E. Histologic and immunohistochemical study comparing xanthoma disseminatum and histiocytosis X. Arch Dermatol 1992; 128 (9): 1207–12.
- Zelger BG, Orchard G, Rudolph P, Zelger B. Scalloped cell xanthogranuloma. Histopathology 1998; 32 (4): 368–74.
- Mahalingam M, Alter JN, Bhawan J. Multiple cellular neurothekeomas – a case report and review on the role of immunohistochemistry as a histologic adjunct. J Cutan Pathol 2006; 33 (1): 51–6.
- Nikkels AF, Arrese Estrada J, Pierard-Franchimont C, Pierard GE. CD68 and factor XIIIa expressions in granular-cell tumor of the skin. Dermatology 1993; 186 (2): 106–8.
- Nickoloff BJ, Griffiths CE. The spindle-shaped cells in cutaneous Kaposi’s sarcoma. Histologic simulators include factor XIIIa dermal dendrocytes. Am J Pathol 1989; 135 (5): 793–800.
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.