
암 진단에서 다중 염색의 가치



갤러리에 들어서면, 벽 크기의 유화가 40보 떨어진 곳에 보입니다. 푸른 잔디, 파란 호수, 하얀 요트. 가까이 다가가서 보면, 사람들이 둑에서 적당한 사회적 거리를 두고 휴식을 취하며 온화한 여름날을 즐기고 있는 것을 볼 수 있습니다. 여러분은 Seurat의 점묘법 걸작인 그랑드자트섬의 일요일 오후(A Sunday Afternoon on the Island of La Grande Jatte) 그림에 빠져듭니다. 캔버스를 면밀히 들여다 보면 무수히 많은 작은 점들이 보이고, 각 점들은 색상, 색조 또는 명암이 미묘하게 다릅니다(그림 1A). 유명한 사진작가 Ansel Adams는 동의하지 않을 수도 있겠지만, Seurat의 캔버스가 단색으로만 구성된 모노플렉스였다면 그 의미를 전달하지 못하거나 지금과 같은 걸작이 되지 못했을 것입니다.
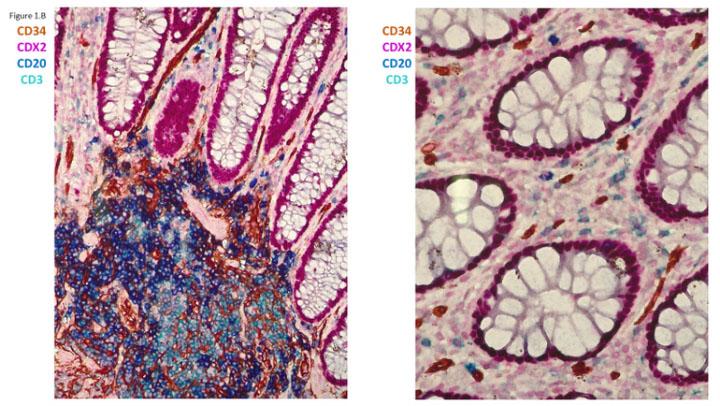
예술가와 마찬가지로, 병리학자는 종종 암 진단을 확인하기 위해 특정 세포 또는 조직을 색상으로 “염색해야” 하나, 예술가와 달리 병리학자들은 오늘날 한 번에 한 가지 색상만을 주로 사용한다는 사실을 알게 되면 놀라실 수 있습니다. 기술 발전으로 인해 이제 여러 색상으로 종양을 염색할 수 있으며, 이는 다중 염색이라 합니다. 인간 결장 내 4개의 상이한 세포 유형을 보여주는 4가지 색상의 다중 표시 예가 그림 1B에 나와 있습니다. 이 논문의 목적은 암 진단 과정을 설명하고 다중 염색이 향후 암 진단에 중요할 이유를 보여주는 것입니다.
2018년, 지구의 76억 명의 인구들 중 1,800만 명이 암을 진단받았습니다1. 이는 진단 수년 전에 신체의 30조 세포2 중 하나에서 DNA 서열의 변화인 돌연변이가 서서히 발생하여 걷잡을 수 없이 성장하는 것으로 시작됩니다. 보다 많은 돌연변이와 보다 많은 성장 후, 언젠가 돌연변이가 종양이 될 때까지 수개월 내지 수년이 경과하고, 이 때 종양이 보이거나 느껴지거나 증상을 야기할 수 있습니다. 종양이 각설탕 크기가 될 때쯤이면, 하나의 돌연변이 세포가 이미 수천 만 개의 세포로 성장했을 것입니다. 그러면 종양은 어떻게 진단합니까?
조직 생검으로부터 암 진단 과정.
각 신체 부위에서 발생하는 암은 공통된 특징을 갖고 있을지라도, 서로 같은 종양은 없습니다. 100년 전과 마찬가지로, 오늘날 암 진단을 위해서는 각 종양의 세포와 조직 형태를 주의 깊게 관찰해야 합니다. 첫 단계는 병리학자가 현미경으로 세포를 검사할 수 있도록 종양 조직의 일부인 생검을 채취하는 것입니다. 생검은 바늘로 채취한 매우 작은 조직 채취로부터 대수술로 절제한 매우 큰 종괴에 이르기까지 다양할 수 있습니다. 종양을 암으로 진단하고 유형을 파악하는 것은 병리학자가 생검을 검사하는 것만큼 간단하지 않습니다. 조직은 현미경으로 검사하기 전 수백 개의 개별 단계를 거쳐야 합니다. 초기에 구조를 보존하기 위해 조직을 포르말린에 화학적으로 “고정”시킵니다. 그 후 이 고정된 조직은 취급, 보관, 처리 간소화를 위해 파라핀 왁스 기질에 포매됩니다. 그런 다음, 조직을 얇은 절편으로 자르고 유리 슬라이드에 올려 놓은 후, 세포와 조직 내 특징 또는 특이한 분자를 보여주기 위해 염색(“도색”)할 수 있습니다.
첫 염색은 원래 섬유 산업에 사용되는 헤마톡실린과 에오신(H&E) 염료로 보통 실시합니다. H&E는 전반적인 세포 구조를 부각시켜 주는 2가지 색 염색으로, 전 세계 조직 진단용 표준입니다. 그 후 H&E 염색에 대한 병리학자의 평가를 통해 진단에 도달하기 위해 추가 염색이 필요한지 결정합니다. 이는 암종, 상피세포 종양 또는 림프종, 림프세포 종양입니까? “특수” 조직화학 염색은 또한 섬유 염료를 사용하나, 주요 유형의 현대 염색은 분자 탐침을 사용하여 조직 내 특정 분자종을 식별하고 분류합니다. 면역조직화학(IHC )은 항체를 사용하여 단백질 또는 탄수화물을 식별하는 반면, 제자리 부합법(ISH )은 핵산을 사용하여 상보성 핵산(DNA 또는 RNA)을 식별합니다.
2020년 암 진단은 일반적으로 정확한 종양 유형을 특정하기 위해 여러 분자 염색을 포함합니다. 2차 소견을 포함한 완전한 진단을 내리고, 예후를 파악하며, 어떤 표적 요법이 환자에게 가장 긴 수명 또는 최선의 생존 기회를 제공할 수 있는지 예측하기 위해 추가 염색이 필요할 수 있습니다. 3R, 즉 신속성, 견고함, 비용을 포함한 많은 이유로, 대다수의 추가 염색은 단일 탐침을 조직의 다른 절편들(슬라이스)에 적용하고 조직 내 분포를 시각화하기 위해 단일 색상을 사용하여 실시하는 단일 염색입니다. 복잡한 사례의 경우, 총 염색 수는 24개를 초과할 수 있으며, 각 염색은 별도의 조직 절편을 필요로 합니다. 조직 절편은 얇을지라도, 이렇게 많은 절편 사용은 낭비일 수 있으며, 다른 진단 검사에 조직이 필요한 경우 특히나 그러합니다. 그 후 병리학자는 환자 종양의 멀티컬러 이미지를 생성하기 위해 머릿속으로 이 각각의 단일 염색들을 통합해야 합니다.
암 진단의 다음 차원인 다중 염색.
오늘날, 다중 염색은 조직 검체에 대한 깊은 통찰력을 얻기 위해 연구에서 자주 실시되나, 기술, 운영, 재정적 요인들로 인해 임상 진단 실험실에서는 암 진단의 일부로 거의 실시되지 않습니다. 다중 염색은 암 진단에 도달하는 데 다음과 같은 여러 잠재적 이점을 제공합니다.
-
조직 보존. 폐암 진단과 치료는 지난 10년 동안 급속한 발전을 이루었으나, 대부분의 폐암 환자들은 암으로 내원할 때 수술을 받을 수 없습니다. 이러한 이유로, 폐암은 종종 매우 작은 검체를 제공하는 바늘 생검으로 진단됩니다. 2020년 중반 기준으로, 표적 요법과 관련된 폐암에는 9개의 다른 분자 이상이 있으며, 각 이상은 별도의 조직 슬라이스를 소비하는 별도의 검사를 요구합니다. 또한 일부 검사에서 차세대 염기서열분석(NGS)을 실시하기 위해 여러 개의 조직 슬라이스를 대규모 표준 실험실 또는 핵심 시설로 전송해야 합니다. 폐암 진단에 다중 염색 채택은 환자를 재생검할 필요 없이 정확한 진단을 내릴 수 있도록 조직을 보존하는 데 도움이 될 수 있습니다.
-
진단 정확도 향상. 전립선암 진단은 일반적으로 12개 이상의 바늘 생검 검사를 수반하고, 환자의 진단과 치료 선택은 전체 생검들에서 암 유형, 정도, 크기 식별에 크게 의존합니다. 일부 전립선암 세포는 생검에서 쉽게 파악할 수 있을지라도, 다른 세포는 양성 세포로 가장할 수 있습니다. PIN4라는 다중 염색은 다른 색상을 사용하여 동일한 절편에서 양성과 악성 전립선 세포를 모두 볼 수 있도록 두 세포의 표지자를 결합하기에, 병리학자가 전립선암을 보다 자신 있게 진단(또는 배제)하는 데 도움이 됩니다.
-
진단 통찰력 향상. 종양이 성장하는 방법과 새로운 요법이 성장을 예방할 수 있는 방법에 대해 더 많이 알게 됨에 따라, 다중 염색은 각 종양에서 이 요인들을 시각화하는 필수 기법이 될 것입니다. 예를 들어, 신세대 약물인 면역 관문 억제제는 환자의 면역체계가 종양과 싸우는 것을 막는 종양의 능력을 차단합니다. 여전히 배워야 할 것이 많을지라도, 위치, 활성화 상태를 포함한 종양 내 다양한 면역 세포 기능이 관문 억제제 작용 방식에 영향을 미친다는 주장이 점점 더 인정받고 있습니다. 예를 들어, 종양 내 림프구는 “활성화” 또는 “소진” 상태일 수 있으며, 이들 각각은 각 세포에 다른 색상으로 염색된 다른 단백질 발현으로 시각화될 수 있습니다. 종양은 종종 항종양 면역반응을 국소적으로 차단하는 골수 유래 억제 세포(MDSC)라는 비종양 세포를 동원합니다. 마지막으로, 신체의 청소 세포인 대식세포의 다양한 집단이 친염증성 또는 항염증성이기에 종양 성장에서 정반대의 역할을 수행할 수 있는 방법에 대한 많은 연구가 이루어졌습니다. 이 두 가지 기능이 M1 또는 M2로 지정된 두 유형의 대식세포에서 기인했을지라도, 최근 관찰 소견은 신체에 두 가지가 아닌 9가지의 다른 유형의 대식세포가 존재함을 시사합니다! 현재로서는 이러한 관찰 소견 중 어떠한 소견도 아직 예후 또는 요법 선택에 영향을 미치는 것으로 나타나지 않았기에 암 환자의 일상적인 진단에 사용되지 않지만, 새로운 연구는 이들이 매우 중요하다는 것을 알려줍니다. 지식이 빠르게 축적되고 있기에, 진단 검사에 종양 면역 침윤물 평가를 포함시키는 것은 단지 시간 문제이며, 이는 다중 염색을 필요로 할 가능성이 높습니다.
암 조직의 절대적인 복잡성과 비교해 암 진단에 대한 현재의 단순 염색 접근법의 단순성을 고려해 봅시다. 실제로, 직경이 1밀리미터의 1/100에 불과한 단일 세포의 복잡성은 놀라울 정도입니다. 각 정상 인간 세포에는 약 21,000개의 유전자를 암호화하는 약 2야드의 DNA, 30억 개의 염기쌍이 들어 있으며, 이들 각각은 많은 상이한 RNA를 만들 수 있습니다. 전형적인 세포에는 어떠한 시점에서든 백만 개의 단백질 분자 합성을 지시한 백만 개 이상의 RNA가 있습니다. 단백질은 공장(각 세포)을 운영하는 작은 고분자 기계의 빌딩 블록과 구성요소입니다. 암은 DNA 질병입니다. DNA 변화는 세포의 구조뿐만 아니라, 종양 세포 내 다수의 작은 기계 기능을 변화시키는 단백질 변화를 야기하여 걷잡을 수 없는 종양 성장을 초래합니다.
암 세포는 비암 세포보다 훨씬 더 많은 이상, 복잡성, 이질성을 보입니다. 그러나 2020년에도 여전히 암 진단을 위해 각 조직 절편에서 한 번에 하나의 분자 유형(핵산 또는 단백질)만을 검사합니다! 형광 또는 질량분석법으로 표지자를 검출하는 새로운 연구 기법은 전통적인 기법보다 한 번에 관찰할 수 있는 분자 수를 10배 증가시킬 수 있으며, 단일 세포 분석이라는 새로운 기법은 각 세포에서 수천 개의 다른 분자들을 정량화할 수 있습니다. 한 종양에서 추출할 수 있는 데이터 양은 엄청나지만, 대부분은 환자 진단과 무관합니다. 병리학자들은 최선의 진단을 내리기 위해 조직 절편 내 분자를 관찰하는 것이 중요하다고 믿습니다. 다중 염색은 각 환자의 조직 절편에서 올바른 분자 세트를 시각화하는 문제를 해결할 수 있습니다. 과제는 암 환자에게 보다 긴 수명 또는 치유를 위한 최선의 기회를 제공할 분자들만을 측정하는 것입니다.
임상 환경에서 다중 염색과 관련된 과제:
다중 염색을 임상 진료에서 구현하는 데 장애물이 없는 것은 아닙니다. 광범위한 시험 검증의 필요성, 시험 실행 시간 증가, 동일한 수의 단일 염색과 비교한 시약 비용, 시험 실행과 해석에 능숙한 기사 부족 등이 이에 해당됩니다. 다중 시험 검증은 이를 구성하는 단일 시험 패널과의 비교를 포함해야 하고, 이는 검증 요건 증가뿐만 아니라 오류를 제거하기 위한 디지털 및 컴퓨터 솔루션이 필요함을 의미합니다. 단일 IHC 와 ISH 시험은 처음에 수동으로 실시했을지라도, 1990년대 자동 로봇 염색기의 도래는 재현성을 개선시키는 한편 시험 소요 시간을 줄여주었습니다. 여전히, 현재의 자동 다중 염색 프로토콜은 보통 단일 염색 프로토콜보다 긴 시간이 소요됩니다. 시약 비용은 여전히 문제이나, 광범위한 채택이 장기적으로 비용을 절감해줄 것으로 예상됩니다. 마지막으로, 다중 조직 시험에 대한 재정지원 옵션이 제한적입니다. 현재 수가는 다중 염색으로 실현한 비용 절감(존재하는 경우)만을 가정하고, 보다 복잡한 분석에 필요한 시간 증가, 중요하게 환자에 대한 잠재적 부가 가치를 고려하지 않습니다.
디지털 병리학이 다중 염색의 약속을 실현할 것입니까?
또한 한 번에 측정한 표지자 수가 증가함에 따라, 시험 해석에 대한 과제도 증가하고 있습니다. 병리학자들은 일반적으로 하나의 세포 유형 또는 조직 구획을 나타내는 단일 염색을 해석하는 데 익숙해 있기에, 각 염색이 서로 다른(중첩되지 않는) 조직 절편 부위를 나타내는 경우 이중(2개의 표지자) 또는 삼중(3개의 표지자) 염색의 해석은 일련의 단일 염색을 해석하는 것보다 일반적으로 더 어렵지 않습니다. 실제로, 많은 상황(예를 들어, 상기 PIN4)에서 동일한 절편에서 2개 이상의 표지자를 동시에 관찰하는 데에는 부가 가치가 있습니다. 그러나 동일한 세포 구획 또는 조직에 2개 이상의 분자가 존재하고 세포 내 분자 양이 상태를 평가하는 데 중요한 경우(예: 무 대 유, 존재하는 경우 높은 수준 대 낮은 수준), 심지어 최고의 병리학자의 눈과 뇌도 이 작업에 미흡합니다. 이제 세포당 30 또는 3,000개의 분자를 시각화하는 것을 상상해 보십시오! 분명히 이미지 분석에 도움이 되는 컴퓨터 프로그램이 해석에 필요합니다. 다행스럽게도, 우리는 “디지털 병리학” 시대에 빠르게 진입하고 있으며, 이 시대에 환자 조직 해석은 곧 전통적인 현미경보다 컴퓨터 화면에서 실시하게 될 가능성이 높습니다. 디지털 병리학 채택과 함께, 병리학자가 다중 염색이 생성할 수 있는 복잡한 데이터세트를 해석하는 데 도움이 될 분자 정량화와 인공 지능을 포함한 “앱”이 도래할 것입니다.
미래에 대한 전망
암 치료의 발전은 각 환자의 암에 특이한 분자 이상과 점점 더 관련이 있으며, 이는 각 환자의 생검 정밀검사의 복잡성을 증가시켰습니다. 암 생검에서 조사가 필요한 분자 수가 계속하여 증가함에 따라, 다중 염색이 제한된 조직 사용을 최대화하고, 진단 정확도를 개선하며, 진단 통찰력을 강화하고, 예후의 보다 효과적인 예측인자로 기능하며, 요법 선택을 안내하는 역할을 수행함으로써 생검 분석에서 보다 큰 역할을 수행할 것으로 생각됩니다. 염색 기술의 발전과 더불어, 다중 염색의 완전한 채택은 점점 더 개인화된 진단과 맞춤형 요법을 지원하기 위해 디지털, 컴퓨터, 궁극적으로 인공 지능 도구를 필요로 할 것입니다. 의료 행위가 여전히 예술과 과학의 동등한 조합인 것처럼, 병리학자의 조직 내 분자 해석은 암 환자의 정밀 치료와 결과 개선을 가능하게 하는 암 조직의 선명한 개요도를 생성할 것입니다.

발표자 소개

Keith Wharton has 30+ years of experience in academic and biopharma settings, including Leica Biosystems, Novartis, and Biogen. Following board certification in anatomic pathology and fellowship training in autopsy pathology and developmental biology at Stanford University, he ran an NIH-funded research laboratory at UT Southwestern Medical Center and held several leadership positions including Pathology course director, Director of the Laboratory of Molecular Pathology, and Associate Dean.

Jonathan Roy Vice President of Pharma Partnerships, Jon is leading Companion Diagnostic development for Leica Biosystems. He has spent the last 10 years focused on companion diagnostic development and implementation globally both at Leica and as Head of Commercial Strategy for Companion Diagnostics at GlaxoSmithKline.

Kimberly Byrwa-Neff is a registered nurse with a background in both clinical nursing and in evidence generation in industry. Her clinical expertise lies in cardiology and oncology, specifically breast cancer. As a nurse, black belt in process excellence, daughter of a breast cancer patient, and survivor of breast cancer herself she brings the full patient experience to her work to improve care for breast cancer patients. Kimberly has authored numerous papers and presented improvement in clinical outcomes as a result of working with breast teams across the country.
참조 문헌
1. Globocan 2018, World Health Organization, IARC Retrieved from 900 World Fact Sheet The Global Cancer Observatory May, 2019. Retrieved from https://acsjournals.onlinelibrary.wiley.com/doi/full/10.3322/caac.21492
2. Sender, R., et.al., PLOS Biology, Revised Estimates for the Number of Human and Bacterial Cells in the Body; Aug. 19, 2016 Retrieved from: https://journals.plos.org/plosbiology...
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.