
특수 염색의 유형, 특징 및 방법 III부: 미생물 - 박테리아와 곰팡이

미생물의 정의
미생물은 박테리아, 곰팡이, 원생 동물 및 바이러스 등의 살아 있는 유기체입니다. 미생물은 크기가 작아 현미경을 사용해야만 볼 수 있으며 전자 현미경이 필요한 경우도 있습니다. 박테리아, 곰팡이 및 원생 동물은 조직 화학 절차로 동정 및 분류될 수 있으며 바이러스는 일반적으로 면역 조직 화학 절차로 동정됩니다
미생물 개요 - 박테리아
미생물은 마이크로 밀리미터 단위 크기의 단세포 유기체로 구성됩니다. 인체에는 일반적으로 결핵균(mycobacterium tuberculosis), 나병균(mycobacterium leprae) 및 헬리코박터 파일로리균(helicobacter pylori) 등 세 가지가 있습니다.
결핵균
결핵의 원인균으로, 운동성이 없고 막대 모양이며 "항산성"이라는 특징으로 동정됩니다. "항산성"은 일단 흡수된 후에는 산성 린스에 넣어 배양할 때 간균을 염색하는 데 사용된 염료를 제거해서는 안 된다는 점을 의미합니다. 일반적인 동정 방법은 AFB 염색이며 항산성 박테리아 염색이라고도 합니다.
마이콜릭 산은 항산성의 원인 메커니즘입니다. 박테리아 벽에서 마이콜릭 산이라고 하는 왁스 물질이 생성됩니다. 이 산이 박테리아 세포 벽 내 물질과 만나면 산성 알코올 처리를 통한 탈색에 대한 저항력이 생깁니다. 가장 많이 사용되는 AFB 염색은 Kinyoun 카르볼 푹신 또는 Ziehl-Neelsen 카르볼 푹신입니다. 두 용액 모두 절차와 결과는 유사합니다.
Kinyoun 카르볼 푹신
절차
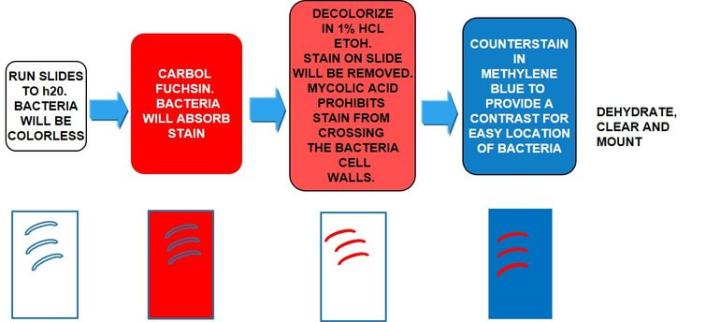
결과
절차
배양 시간은 제조업체에 따라 다를 수 있습니다.
|
1. |
물로 슬라이드를 세척 |
|
|
2. |
카르볼 푹신(상온) |
30∼60 min |
|
3. |
60c로 가열하면 배양 시간을 단축할 수 있음. |
|
|
4. |
흐르는 물에 잘 헹굼. |
5 min |
|
5. |
1% HCL 산성 알코올(70% 알코올) |
10 sec |
|
6. |
흐르는 물에 잘 헹굼 |
2 min |
|
7. |
메틸렌 블루(methylene blue)를 사용하여 원하는 색상을 만듬. |
30∼40 sec |
|
8. |
흐르는 물에 짧게 헹굼. |
15 sec |
|
9. |
알코올로 신속하게 탈수 |
|
|
10. |
10. 투명화하고 봉입 |
AFB 염색 문제 해결:
카르볼 푹신 염색 후에는 물로 잘 헹궈 남은 용액을 제거해야 합니다. 수위는 전체 슬라이드를 맨 위까지 덮을 정도여야 합니다. 염색이 남아 있으면 조직에 흔적이 남아 결과를 망칠 수 있습니다. 탈색이 빠르게 진행됩니다. HCL/70% EtOH에서 유리 슬라이드가 깨끗해지고 조직이 연한 분홍색으로 표시될 때까지 배양합니다. 탈색 후에는 슬라이드에 산/EtOH가 남아 있지 않도록 흐르는 물에 잘 씻습니다. 메틸렌 블루를 적게 사용할수록 좋습니다. 이 대조 염색을 많이 사용하면 AFB 간균이 안 보일 수 있습니다. 메틸렌 블루를 너무 많이 사용하는 것과 너무 적게 사용하는 것은 백지 한 장 차이입니다. 너무 많이 사용하면 잘 씻기지 않아 간균이 안 보일 수 있습니다. 너무 적게 사용하면 모두 씻겨 나가 대조 효과를 얻지 못할 수 없습니다. 가장 좋은 정답은 시행 착오와 경험입니다.
앞서 말한 것처럼 메틸렌 블루는 알코올로 쉽게 세척되므로 탈수에 100%부터 시작해야 하며 슬라이드를 빠르게 2번 털어 슬라이드에서 물기만 제거해야 합니다.
나병균
나병을 유발하며 결핵균과 유사한 항산성을 갖지만 그 효과는 훨씬 적습니다. 일반적으로 사용되는 염색은 Fite’s Faraco입니다.
Fite’s Faraco
절차

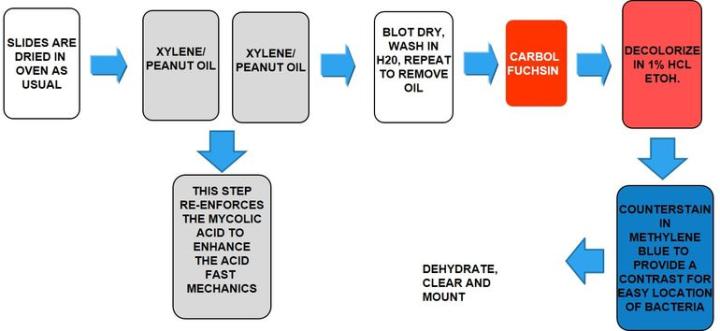
결과
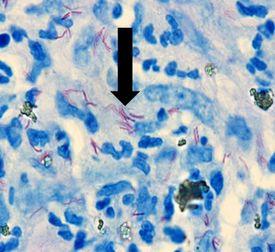
프로토콜
배양 시간은 제조업체에 따라 다를 수 있습니다.
|
1. |
슬라이드를 오븐에 건조 |
|
|
2. |
자일/낙화생유(땅콩기름)를 50/50 비율로 섞어 배양 |
15 min |
|
3. |
50/50 혼합액으로 다시 반복 |
15 min |
|
4. |
물기를 닦아내고 물에 헹구는 절차를 반복하여 오일 제거 |
5 min |
|
5. |
Fite 카르볼 푹신(상온) |
20 min |
|
6. |
흐르는 물에 잘 헹굽니다. |
|
|
7. |
1% HCL/70% 알코올 |
1∼5 secc |
|
8. |
흐르는 물에 헹굼 |
|
|
9. |
메틸렌 블루 |
10∼20 sec |
|
10. |
흐르는 물에 신속하게 헹굼 |
|
|
11. |
물기를 닦아내고, 알코올을 사용하지 않고 투명화한 후 봉입 |
Fite’s Faraco 염색 문제 해결
일반적인 왁스 제거 프로토콜에 따라 실수로 자일렌과 알코올에 슬라이드가 닿으면 새 슬라이드를 박절하여 처음부터 다시 시작합니다. 최적의 결과를 얻으려면 Kinyoun 카르볼 푹신과 동일한 지침을 따릅니다.
헬리코박터 파일로리균
나선형 모양으로 위염, 위궤양 및 위암종과 관련이 있습니다. 은친화성 성질을 갖고 있어 은을 흡수하거나 환원시키지 못합니다. 일반적인 염색에는 Warthin Starry Silver 염색 또는 많은 수정 방법 중 하나인 Giemsa 및 면역 화학 염색(가장 민감)이 있습니다.
Warthin Starry Silver
절차
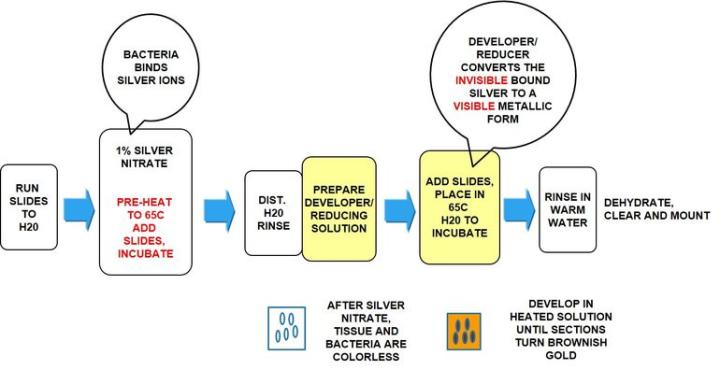
결과
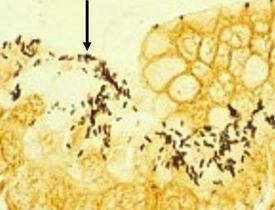
프로토콜
배양 시간은 제조업체 지침에 따라 다를 수 있습니다
참고: Warthin Starry Silver 염색은 헬리코박터 파일로리균 뿐만 아니라 많은 다양한 미생물을 확인하는 데 사용됩니다. 따라서 실제 프로토콜은 아래 헬리코박터 파일로리균 프로토콜과 다를 수 있습니다.
|
1. |
물로 슬라이드를 세척 |
|
|
2. |
초순수에 헹굼 |
|
|
3. |
0.5% ∼ 1% 질산은 – 65°C까지 예열 |
3∼5 min |
|
4. |
현상액/환원액 |
1∼5 min |
- 용액에 들어 있는 커플린 자(coplin jar)에 슬라이드 삽입.
- 65°C로 예열한 수조에 커플린 자 삽입.
- 조직 절편이 갈색/황금색이 될 때까지 배양

|
5. |
따뜻한 물에 헹굼 |
2∼3 min |
|
6. |
무수 알코올에 넣어 탈수 |
|
|
7. |
투명화하고 봉입 |
헬리코박터 파일로리균의 Warthin Starry Silver 염색 문제 해결:
헬리코박터 파일로리균의 Warthin Starry Silver 염색 문제 해결:
Warthin Starry는 익숙해지기가 쉽지 않은 염색이므로 용액을 혼합할 때 제조업체의 모든 지침을 준수해야 합니다. 깨끗한 유리 용기와 함께 필요한 경우 초순수를 사용합니다. 은과 현상액/환원액을 담을 수조를 미리 예열해야 합니다. 슬라이드를 넣을 때 은 온도는 65°C여야 합니다. 현상액/환원액에 따뜻해지고 조직이 황금빛 갈색으로 현상되기 시작하면 거의 완료된 것입니다. 현상액/환원액을 섞으면 슬라이드가 더욱 고르게 염색됩니다.
참고: 전자레인지를 사용하여 수조를 가열할 수도 있습니다. 이때 시간을 조정해야 합니다.
Giemsa
Giemsa는 다양한 색조를 가진 염료로 구성된 다색 염색입니다.
절차
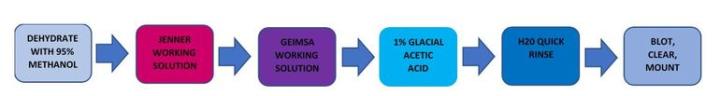
결과
프로토콜
배양 시간은 제조업체 지침에 따라 다를 수 있습니다.
|
1. |
95% 메탄올로 탈수 |
|
|
2. |
Jenner 염색 용액 |
10 min |
|
3. |
Giemsa 염색 용액 |
45 min |
|
4. |
1% 빙초산액 |
10 sec |
|
5. |
흐르는 물에 빠르게 헹굼 |
|
|
6. |
물기를 잘 닦아내고 투명화한 후 봉입 |
헬리코박터 파일로리균의 Jenner-Giemsa 염색 문제 해결:
Jenner와 Giemsa 모두 매우 불안정한 용액으로 사용할 때마다 새로 만들어야 합니다. 두 용액 모두 사용하기 전에 여과합니다. 빙초산 단계가 매우 중요합니다. 너무 짧게 염색하면 세포가 뚜렷하게 분화되지 않습니다. 너무 오래 염색하면 염색 효과가 대부분 사라집니다. 알코올로 탈수하면 헬리코박터 파일로리균의 모든 파란색이 씻겨져 나가므로 종이나 천으로 빨아들이는 방식으로 닦아냅니다.
헬리코박터 파일로리균의 세 가지 염색 절차 비교
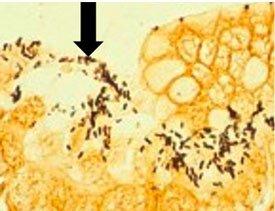
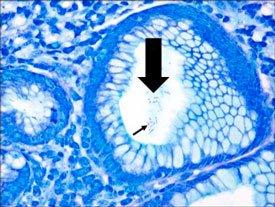
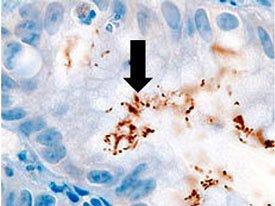
미생물 개요 - 곰팡이
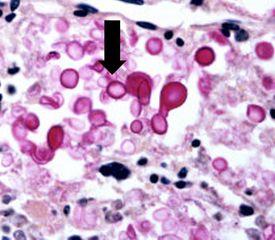
곰팡이는 핵과 세포벽이 다른 단세포 및 다세포 유기체로 구성됩니다. 인체 질병을 유발하는 대표적인 곰팡이에는 크립토코커스 네오포르만스(cryptococcus neoformans), 히스토플라스마 캡슐라툼(histoplasma capsulatum) 및 주폐포자충(pneumocystis carinii) 등 세 가지가 있습니다.
크립토코커스 네오포르만스
전 세계에 분포하며 인간에게 수막염을 일으킵니다. 일반적으로 면역력이 약한 사람이 감염됩니다. 뮤시카민(mucicarmine) 염색과 메테나민 은(methenamine silver) 염색으로 모두 포자를 명확하게 확인할 수 있습니다(다음 절차 참조).
뮤시카민
절차
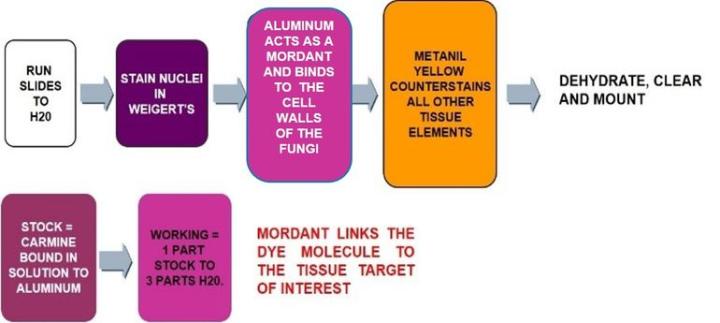
결과
프로토콜
배양 시간은 제조업체 지침에 따라 다를 수 있습니다.
|
1. |
물로 슬라이드를 세척합니다. |
|
|
2. |
Wiegert 헤마톡실린 처리 |
5∼10 min |
|
3. |
흐르는 물에 헹굼 |
|
|
4. |
뮤시카민 용액 처리 |
20∼30 min |
|
5. |
흐르는 물에 헹굼 |
|
|
6. |
메타닐 옐로(Metanil yellow) |
1∼3 min |
|
7. |
흐르는 물에 짧게 헹굼 |
|
|
8. |
탈수하고 투명화한 후 봉입 |
뮤시카민 염색 문제 해결:
뮤시카민 염색 방법은 제조업체 지침을 따르십시오. 지침에 따라 희석해야 하며 적합한 희석수(증류수 또는 수돗물)를 사용해야 합니다. 새 Wiegert 염색을 사용합니다. Wiegert 염색이 보라색이 아닌 갈색에 가까우면 손상된 것으로 핵이 제대로 염색되지 않습니다. Wiegert 염색을 하루 동안 사용할 수 있지만 그 이상 사용할 수는 없습니다.
히스토플라스마 캡슐라툼
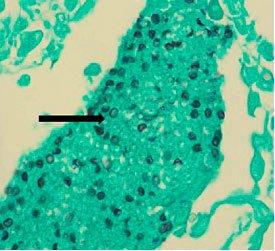
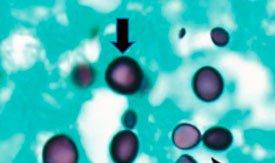
히스토플라스마증을 유발합니다. 호흡 시 포자를 들이마셔 감염되며 독감과 유사한 증상이 나타납니다. 치료하지 않으면 몸 전체에 퍼져 사망할 수 있습니다. 면역력이 약한 환자에게서 더 잘 나타나며 Gomori 메테나민 은(methenamine silver) 염색으로 확인할 수 있습니다.
주폐포자충
과거에는 원생 동물로 분류되었지만 현재는 핵산과 생화학적 분석을 토대로 곰팡이로 간주됩니다. 면역력이 약한 환자에게 치명적인 폐렴을 유발합니다. Gomori 메테나민 은(methenamine silver) 염색으로 확인할 수 있습니다.
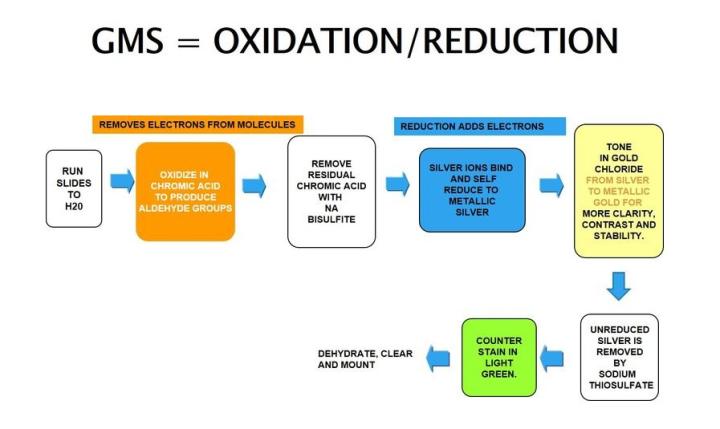
Gomori 메타나민 은
Gomori 메테나민 은 염색은 세포의 은친화성 성질을 활용합니다. 외부 도움 없이 눈에 보이지 않는 은 이온을 눈에 보이는 금속성 은으로 환원할 수 있으며 헬리코박터 파일로리균의 은친화성과는 정반대입니다.
절차
결과
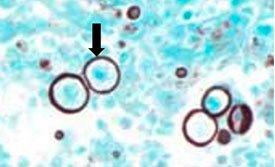
프로토콜
|
1. |
물로 슬라이드를 세척 |
|
|
2. |
크롬산으로 산화시킴 |
10 min |
|
3. |
흐르는 물에 잘 헹굼 |
3 min |
|
4. |
아황산수소나트륨 |
1 min |
|
5. |
흐르는 물에 헹굼 |
|
|
6. |
60c의 메테나민 은 용액으로 배양 |
10∼20 min |
|
7. |
배양 시간은 주입 속도에 따라 결정됨 |
|
|
8. |
초순수에 헹굼 |
|
|
9. |
염화금 |
1∼2 min |
|
10. |
흐르는 물에 헹굼 |
|
|
11. |
티오황산나트륨 |
1 min |
|
12. |
흐르는 물에 헹굼 |
|
|
13. |
연한 녹색 대조 염색 |
30∼40 sec |
|
14. |
흐르는 물에 빠르게 헹굼 |
|
|
15. |
탈수하고 투명화한 후 봉입 |
GMS 문제 해결:
완벽하게 산화되도록 크롬산을 자주 교체해야 하며 그 횟수 분석하는 슬라이드 수에 따라 다릅니다. 사용하지 않으면 용기를 닫아서 보관합니다. 수작업 시 사용하는 가열 방법(수조 또는 전자레인지)에 따라 다소의 시행 착오를 거쳐야 시간을 결정할 수 있습니다. 연한 녹색을 과하게 염색하면 확인할 조직이 안 보일 수도 있습니다.
폐포자충용 GMS
발표자 소개

Carolyn Doan received her ASCP registration in 1969 after completing classes at Georgia State University and St Joseph school of Histotechnology in Atlanta, Georgia. For 40 years she shared her passion for histology in research (at Yerkes Primate Research Center), in the clinical world (managing the Pathology Department at Florida Hospital in Orlando and serving on the board of the Florida State Licensure Task Force and as president of the Florida State Society for Histotechnology), and in industry (as a Sales executive, Marketing Manager and North American staining sales specialist). Since her retirement in 2013, she founded Creative Histology Consulting.
참조 문헌
Geoffrey Rolls. “101 Steps to Better Histology – A Practical Guide to Good Histology Practice”. Pathology Leaders/articles
Shaikh, Dr. Imran, “Special Stains in Histopathology.” Kem Hospital, 2012
Ellis, Roy. IMVS Division of Pathology, The Queen Elizabeth Hospital, Woodville Road, South Australia
Wikipedia encyclopedia – Pneumocystis Carinii
Kerr, DA: Improved Warthin Starry Method for Tissue Sections; Am J Clin Pathol; 1938, 8:63-67
Dacie and Lewis, Practical Hematology, 12th edition, 2017
ncbi.nlm.nih.gov/pubmed/8173783 - The Identity of Pneumocystis Carinii
Sheehan/Hrapchak. “Theory and Practice of Histotechnology.” Microorganisms. 2nd edition, 13: 233-251
Derm101.com Ackerman, A. Bernard (2000)
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.