
Grundlagen der H&E-Färbung Teil 4: Fehlerbehebung H&E

Obwohl es sich bei der H&E-Färbung um eine relativ einfache Technik handelt, kann die Bildung von Artefakten das Färbeergebnis stören. Diese Artefakte können ganz unterschiedliche Ursachen haben.
Die Probenpräparation spielt eine wesentliche Rolle, wenn gute Färbeergebnisse erreicht werden sollen. Unregelmäßigkeiten in der Schnittdicke, Rattermuster, „berstendes“ Gewebe und Schwebstoffe aus dem Wasserbad können sich allesamt negativ darauf auswirken, wie das Gewebe die Färbung aufnimmt.
Variationen in der Schnittdicke sind meist das Ergebnis einer schlechten Schneidetechnik und ungleichmäßiger Drehung des Handrads am Mikrotom. In vielen Laboren erfolgt die Schnitterstellung im Mikrotom inzwischen automatisiert, wodurch sich eine erhöhte Gleichmäßigkeit der Schnittpräparate erreichen lässt. Die Vermeidung von Verletzungen durch wiederholte Bewegungen ist ein positiver Nebeneffekt.

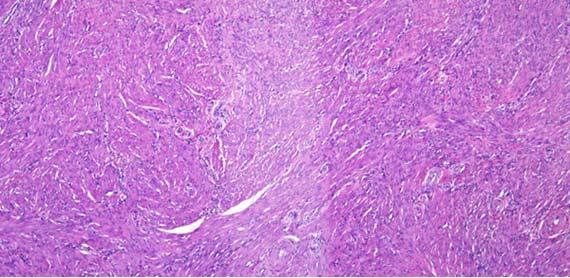
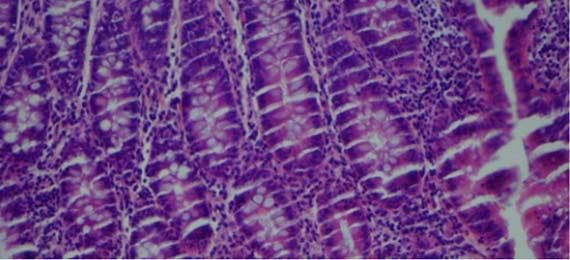
Rattermuster und das Bersten von Schnitten sind typischerweise auf die Gewebeinfiltration zurückzuführen. Während Rattermuster das Ergebnis einer Überinfiltration bzw. exzessiven Entwässerung sind, beruhen „Berstartefakte“ auf einer unzureichenden Infiltration der Probe. Auch die roten Blutkörperchen können als Indikator für eine Überinfiltration herangezogen werden.
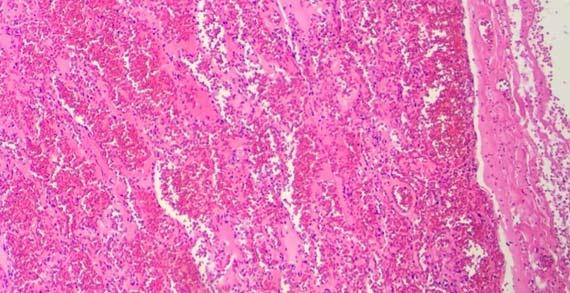
Wasser wird gern als Differenzierungsmittel für Eosin verwendet, da es die schonende Entfernung überschüssigen Eosins vom Objektträger ermöglicht. Die entwässernden Alkohollösungen und die erste Charge reinen Ethanols können genügend Wasser enthalten, um eine Aufhellung des Eosins und eine weitere Differenzierung zu verursachen. Zu viele Passagen durch „Wasser oder verdünnten Alkohol“ reduzieren die Intensität der Eosinfärbung und resultieren damit in einer Unterfärbung zytoplasmatischer Strukturen.
Die Kontamination der Alkohole, die im Anschluss an die Eosinfärbung zur Entwässerung verwendet werden, erfolgt oft durch den ungewollten Übertrag von Wasser aus den vorherigen Schritten. Um eine zu starke Kontamination mit Wasser zu vermeiden, müssen die Reagenzien regelmäßig gewechselt werden. Andernfalls nimmt der Wassergehalt weiter zu, bis schließlich auch die Xylole erreicht werden, die vor dem Eindecken zum Einsatz kommen. Überschüssiges Wasser im Xylol kann mit der Zeit zu einem Austreten des Eosins aus dem Gewebe führen. Auf dem Objektträger wird dann ein rosa Dunst erkennbar. Dieses Artefakt kann auch dann auftreten, wenn das Xylol nicht sichtbar mit Wasser kontaminiert ist.
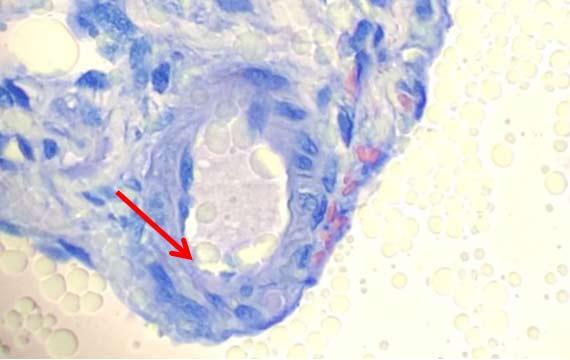
Aber die Verschleppung von Wasser aus vorhergehenden Schritten ist nicht die einzige Möglichkeit zur Kontamination von Xylolen: Hohe Luftfeuchtigkeit kann den Prozess des Wassereintrags in Xylol beschleunigen.
Je nach Standort kann zudem die Wasserqualität sehr unterschiedlich sein. Der pH-Wert des Wassers, eine eventuelle Fluoridierung und die Präsenz von Mineralien entscheiden nicht nur darüber, wie die Farbstoffe vom Gewebe aufgenommen werden, sondern auch, wie lange sie erhalten bleiben. Hämatoxylin zum Beispiel ist leicht sauer. Bei Verwendung leicht alkalischen Leitungswassers kann der pH-Wert der Hämatoxylinlösung steigen, wodurch der Farbstoff an Effektivität verliert. Wenn die Leitungswasserqualität schwankt oder generell unzureichend ist, sollte der Einsatz von demineralisiertem Wasser in Betracht gezogen werden. Versichern Sie sich dabei, dass der Wasserdruck für den Färbeautomaten ausreicht.
Gefrorenes Gewebe stellt hohe Ansprüche an die Färbung. Auf der einen Seite ist das Timing enorm wichtig, auf der anderen Seite stehen die Labore häufig unter Druck, möglichst schnell Ergebnisse zu liefern. Da ist es nicht leicht, ein gesundes Gleichgewicht zwischen qualitativ hochwertigen Färbungen und kurzen Bearbeitungszeiten zu finden.
Häufig sieht man auch Präparate, die ungleichmäßig gefärbt sind, wobei die Ursachen nicht im gefrorenen Zustand der Schnitte liegen. Tatsächlich sind die Hauptgründe eine übereilte Fixierung und das Spülen des Objektträgers vor der Färbung. Denken Sie daran, dass die Medien, die zur Unterstützung gefrorenen Gewebes während der Mikrotomie verwendet werden, wasserlöslich sind und aus der Probe entfernt werden müssen – ganz ähnlich wie das Paraffin aus Standardproben entfernt wird, bevor sie gefärbt werden können. Beide, die genannten Medien und Paraffin, wirken als Barriere und behindern das Eindringen des Farbstoffs ins Gewebe. Und, genau wie beim Wachs, sind am Ende des Färbeprozesses keinerlei Medien mehr auf dem Objektträger zu erkennen, da sie während der einzelnen Färbeschritte entfernt wurden.
In der Regel werden die Proben nicht vom Laborpersonal entnommen und daher ist eine entsprechende Schulung des Personals, das für die Probenahme verantwortlich ist, unerlässlich. Die Entnahme von Proben mit Gazetupfern, Papiertüchern, Wattestäbchen und ähnlich saugfähigen Trägern kann zum Austrocknen des Gewebes führen. Dieses Artefakt ist am häufigsten bei Biopsien zu sehen, insbesondere wenn mit einem einzigen Instrument mehrere Proben vom selben Patienten genommen werden. In diesen Fällen, in denen das Spülen des genannten Instruments mit Formalin dem Patienten schaden könnte, sollten porenfreie, nicht saugfähige Materialien verwendet werden, um die Gewebeprobe aus dem Instrument zu nehmen. Außerdem kann Kochsalzlösung verwendet werden, um die Probe aus dem Instrument zu spülen, da sie so kein Wasser verliert.
Gewebeproben sind nach ihrer Entnahme unverzüglich in Fixiermittel zu legen, um eine ordnungsgemäße Fixierung zu gewährleisten. Formalin ist das am häufigsten verwendete Fixiermittel und sorgt für gute nukleäre Details. Dabei sollte Formalin wie jedes andere Reagens behandelt werden, insbesondere in Bezug auf Lagerzeiten und Verfallsdatum. Wenn Formalin direktem Sonnenlicht ausgesetzt wird, kann der pH-Wert der Lösung fallen, sodass Gewebeproben unbeabsichtigt in ein saures Milieu gegeben werden. Die erhöhte Azidität von Fixiermitteln hat im Wesentlichen zwei Effekte auf das Gewebe:
- Eine Verätzung der Außenränder der Probe
- Übermäßiges Austrocknen des Gewebes
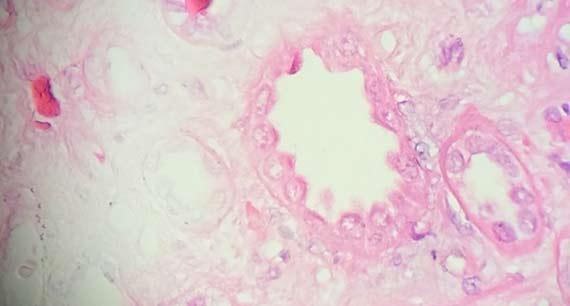
Bei der Verätzung der Probenränder nehmen diese ein „verbranntes“ Erscheinungsbild an. Das so veränderte Gewebe, im Wesentlichen geronnenes Protein, stellt ein Hindernis für die regelrechte Entwässerung und Infiltration der Probe dar.
Bei etwas geringerem Säuregehalt kommt es nicht zur Verätzung, wohl aber zum Austrocknen der Probenränder. Wann immer Zweifel an der Unbedenklichkeit des Formalins bestehen, empfiehlt es sich, mit frischen Reagenzien zu arbeiten, um das Risiko von Gewebeschäden zu mindern.
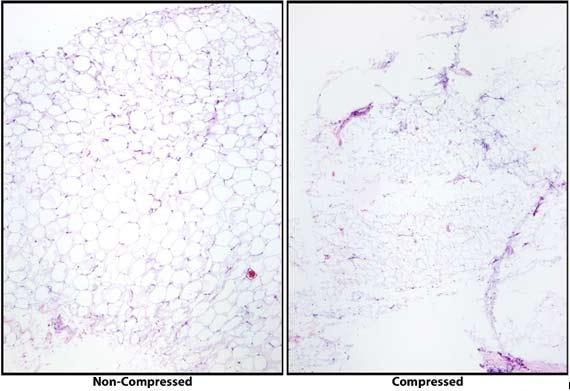
Gewebeinfiltrationsautomaten verwenden immer spezifischere Protokolle und auch wir sollten unsere Techniken dem Fortschritt wissenschaftlicher Erkenntnis anpassen. Die Methoden werden stetig optimiert, um die Qualität der Ergebnisse zu steigern und die Bearbeitungszeiten zu verkürzen, wo immer es möglich ist. Aus diesem Grund ist es nicht mehr sinnvoll, alle Proben nach dem gleichen Protokoll zu verarbeiten. Kleine Proben über Nacht zu verarbeiten bedeutet eine allzu lange Entwässerung und übermäßige Dehydratation, was das Schneiden erschwert. Einweichen kann ein wenig Abhilfe schaffen, aber oft erweisen sich diese Proben als rissig. Für große Proben, auf die ein Protokoll angewendet wird, das für Biopsien vorgesehen ist, gilt das Gegenteil: Sie entwässern nur unzureichend. Es ist unwahrscheinlich, dass sie geschnitten werden können, bis sie die einzelnen Prozessschritte in angemessener Zeit durchlaufen haben.
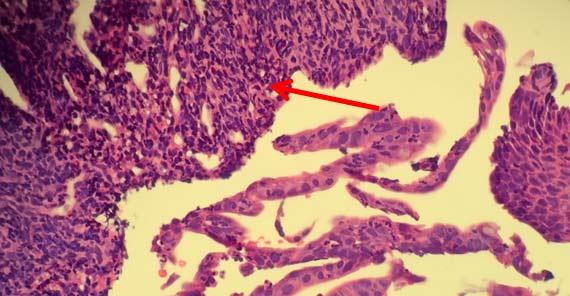
Blasenbildung im Kern tritt auf, wenn nukleäre Proteine gerinnen. Dieses Artefakt ist oft durch eine unzureichende Fixierung und anschließende Hitzeeinwirkung zu erklären. Ein Fixiermittel mit hohem pH-Wert kann ebenfalls zur Blasenbildung führen. Dieses widrige Milieu lässt die Proteine um kleine Tropfen Gewebsflüssigkeit herum gerinnen, was ihnen das Aussehen von Seifenblasen verleiht. Leider gibt es keine Möglichkeit, diesen Fehler zu beheben, sobald er aufgetreten ist.
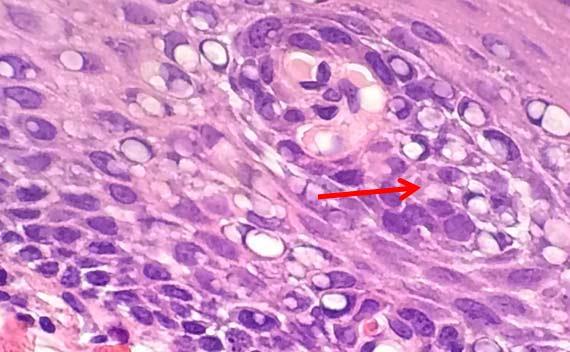
Nach dem Aufziehen der Schnitte werden nasse Objektträger häufig in einen Ofen gestellt, um zu trocknen. Hohe Temperaturen, z. B. 70 °C, können dazu führen, dass das Wasser unter dem Schnitt verdunstet und hierbei das Gewebe durchdringt. Dabei können Proteine gerinnen, was zum bereits beschriebenen Seifenblasenartefakt führt. Die einfachste Möglichkeit, eine solche Blasenbildung zu vermeiden, ist, eine niedrigere Ofentemperatur zu wählen. Außerdem hilft es, die Objektträger kurze Zeit an der Luft trocknen zu lassen, bevor sie in den Ofen gestellt werden.
Verunreinigungen durch Schwebepartikel sind leider sehr häufig. Um die Kontaminationsquelle ausfindig zu machen, ist zu untersuchen, wo genau sich die Verunreinigungen in Bezug auf das Gewebe befinden. Wenn sie auf der gleichen Ebene fokussiert werden können wie die eigentliche Gewebeprobe, stammen sie sehr wahrscheinlich aus dem Block. In diesen mögen sie beim groben Zuschnitt oder beim Einbetten der Probe gelangt sein.
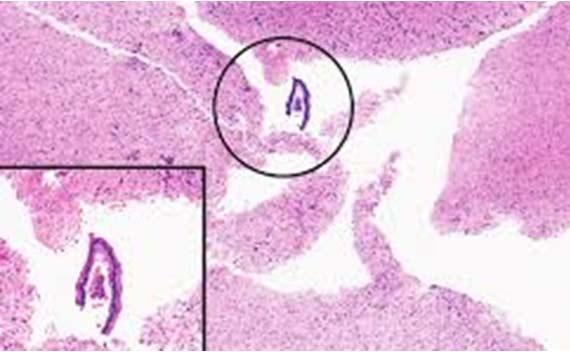
Bei einer Kontamination von außen, z. B. aus dem Wasserbad oder über die Färbereagenzien, liegen die Verunreinigungen in der Regel über dem Gewebe oder auf einer ganz anderen Ebene. Daraus lassen sich mögliche Maßnahmen ableiten, um einer Kontamination vorzubeugen. Die Arbeitsplätze, an denen die Proben grob zugeschnitten und eingebettet werden, sind sauber zu halten. Auch in Bezug auf das Wasserbad und die Reagenzien ist Sauberkeit wichtig, wofür es regelmäßiger Wechsel bedarf.
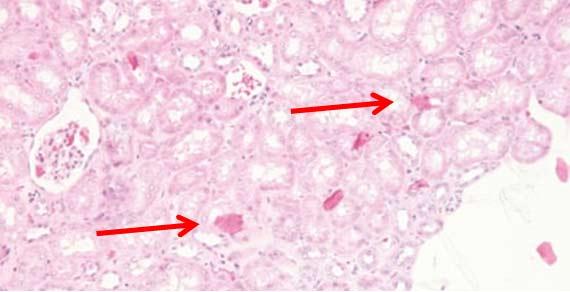
Bakterien und Pilze können an all diesen Stellen, einschließlich der Reagenzienbehälter, wachsen, wenn sie nicht in geeigneten Abständen gereinigt werden. Befolgen Sie die Anweisungen der Hersteller bezüglich der Wartung Ihrer Geräte. Beachten Sie, dass bestimmte Desinfektionsmittel zwar sehr effektiv wirken, aber Probleme mit Ihren Geräten verursachen können.
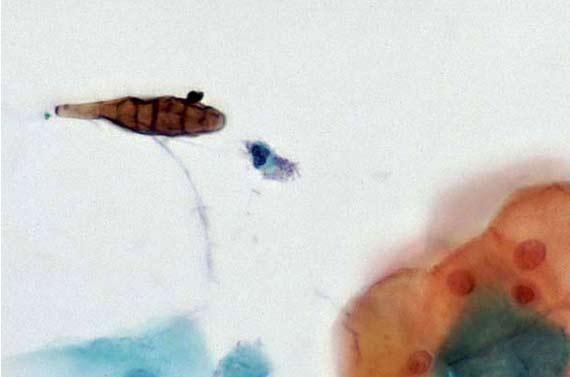
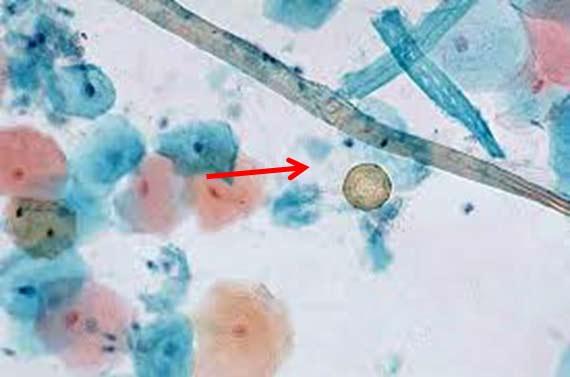
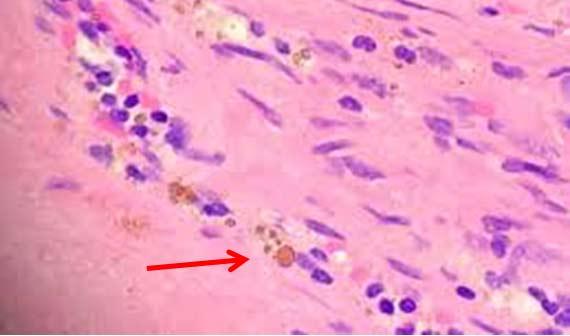
Denken Sie daran, dass der menschliche Körper ebenfalls Stoffe absondert, die zu einer Verunreinigung der Schnitte führen und auf H&E-gefärbten Präparaten als Pigment sichtbar werden können. Dazu zählen Melanin, Hämosiderin aus gealterten roten Blutkörperchen und entzündlicher Debris. Auch bestimmte Fixiermittel können die Bildung von Pigment bewirken. Wenn der Pathologe nicht darüber informiert wird, dass die Probe beispielsweise in Zenker-Lösung fixiert wurde, kann das seine Diagnose beeinflussen. Zenker-Lösung enthält Kaliumdichromat und Quecksilberchlorid und findet aufgrund ihrer Toxizität nur noch selten Anwendung, wird aber in einigen Labors nach wie vor hausgemacht. Notieren Sie alle Auffälligkeiten während der Fixierung, die sich auf die Färbung auswirken könnten.
Histologielabore haben traditionell allerlei Techniken verwendet, um die Haftung von Gewebeproben auf Objektträgern zu verbessern. In der Vergangenheit, als geladene Objektträger für den Routineeinsatz zu teuer waren, hat man Albumin und andere Proteine genutzt, um die Schnitte auf den Objektträgern haften zu lassen. Solche Reagenzien waren (und sind nach wie vor) kommerziell erhältlich als Zusätze zum Wasserbad. Die tatsächliche Herausforderung aber besteht in der Konsistenz. Die einzelnen Mitarbeiter des Labors mögen das Wasserbad unterschiedlich befüllen und ihm verschiedene Mengen an Haftstoff hinzufügen. Wenn der eine großzügig mit dem Haftvermittler umgeht, der andere eher sparsam ist, kann das zu wesentlichen Unterschieden in der Hintergrundfärbung führen.
Die beschriebenen Haftstoffe haben also ihre Grenzen, z. B. in Bezug auf die Hintergrundfärbungen in H&E-Präparaten, und können auch immunhistochemische Färbungen stören.
Geladene Objektträger sind heute leichter zugänglich als noch vor einigen Jahren und eignen sich gut für Färbungen, wobei das Risiko einer störenden Hintergrundfärbung und anderer Anomalien, wie sie im Zusammenhang mit Wasserbadzusätzen auftreten, vermindert wird. Da alle Objektträger gleich behandelt sind, ist auch die Variabilität geringer.
Lässt sich aber durch die gleichzeitige Verwendung von Haftvermittlern im Wasserbad und geladenen Objektträgern ein noch besserer Hafteffekt erreichen? Nein, das funktioniert nicht. Beide Methoden basieren auf der Anziehung von Ionen aus dem Gewebe. Wenn sie gemeinsam verwendet werden, heben sich ihre Wirkungen gegenseitig auf: Der Haftstoff aus dem Wasserbad verwandelt den geladenen Objektträger im Wesentlichen in einen einfachen Objektträger ohne Ladung.
Xylolersatzstoffe sind inzwischen weit verfügbar und tragen zur Sicherheit im Labor bei. Denken Sie aber daran, dass auch sie ihre Grenzen haben, wie zum Beispiel eine geringere Toleranz für Wasser. Unter Umständen wird es erforderlich, das Eindeckmedium zu wechseln, da die Kompatibilität der Xylolersatzstoffe mit den gängigen, xylolbasierten Eindeckmitteln nicht unbedingt gegeben ist.
Auch sollte der Umgang mit Xylolersatzstoffen trotz ihrer reduzierten Toxizität nicht weniger sorgfältig sein als mit Xylol. Die gesetzlichen Regelungen zur Abfallentsorgung sind landesabhängig, aber grundsätzlich gilt, dass Xylolersatzstoffe immer auf die gleiche Weise wie Xylol entsorgt werden und nicht in den Abfluss gegossen werden dürfen. Es handelt sich auch hier um potenziell umweltschädliche Kohlenwasserstoffe. Außerdem sind sie mitunter recht geruchsintensiv. Daher brauchen Labore, die Xylolersatzstoffe verwenden, tendenziell eine etwas bessere Belüftung.
Außer Ethanol sind eine Reihe anderer Alkohole auf dem Markt, die für die Färbung genauso gut funktionieren können. Methanol, Isopropanol und Flex werden am häufigsten eingesetzt und können durchaus kostengünstiger sein als Ethanol. Hersteller von Flex-Alkohol kombinieren Ethanol, Methanol und Isopropanol in verschiedenen Formulierungen und es macht durchaus Sinn, sich über deren jeweiligen prozentualen Anteil zu informieren. Wenn Sie Bedenken hinsichtlich der Verwendung eines bestimmten Reagens in einem Färbeautomaten haben, wenden Sie sich an den Hersteller des Geräts. Er kann Ihnen sagen, ob sie kompatibel sind. Stellen Sie weiterhin sicher, dass Ihr Färbeprotokoll intern validiert ist.
Eine der einfachsten Möglichkeiten, um H&E-Objektträger auf Dauer gut aussehen zu lassen, besteht in regelmäßigen Reagenzienwechseln. Die meisten Hersteller machen Angaben zur Anzahl der Objektträger, die in ihren Reagenzien behandelt werden können, bevor sie ausgetauscht werden müssen. Während diese Daten eine wertvolle Orientierungshilfe sind, ist es unter Umständen empfehlenswert, eine Anpassung an die Arbeitsabläufe in Ihrem Labor vorzunehmen. Wenn ein täglicher Wechsel logistisch besser zu machen ist, dann machen Sie das so.
Heute stehen in den meisten Laboratorien Färbeautomaten. Die Automatisierung der Färbung schafft Freiräume für andere Arbeiten und Konsistenz bezüglich der Färbequalität. Aber auch Färbeautomaten arbeiten nicht von selbst – Wartung und Qualitätskontrolle sind weiterhin unerlässlich, um gute Färbeergebnisse zu erhalten. Reinigen und warten Sie Ihren Färbeautomaten gemäß den Angaben des Herstellers.
In Laboren mit hohem Durchsatz ist möglicherweise eine Verkürzung der Wartungsintervalle in Betracht zu ziehen. In jedem Fall sollten Reparatur- und Wartungsarbeiten am Gerät ausschließlich von einem entsprechend geschulten Techniker durchgeführt werden. Die meisten Hersteller bieten Servicevereinbarungen an, die es dem Anwender ermöglichen, einen Kundenservice in Anspruch zu nehmen, und in der Regel beinhalten diese Vereinbarungen auch präventive Wartungsmaßnahmen. Nehmen Sie sich in Acht vor Anbietern, die derartige Dienstleistungen verkaufen möchten, ohne für das jeweilige Gerät zertifiziert zu sein. Schlechter Service von einem externen Anbieter macht die Sache mitunter noch schlimmer und kann teuer werden.
Auch wenn es selbstverständlich scheint, wären Sie wohl überrascht, zu erfahren, wie wenig Zeit manche Labore für die Schulung ihrer Mitarbeiter an den Geräten aufwenden. Die regelmäßige Überprüfung der Kompetenzen der Mitarbeiter sollte Hand in Hand gehen mit Gelegenheiten, eingerostetes Wissen in Webinaren, Workshops oder anderen Schulungen aufzufrischen. So lässt sich sicherstellen, dass alle Anwender verstehen, wie Färbungen und Geräte funktionieren.
Es ist nicht immer einfach, sich darauf zu einigen, welche Methode die beste ist. Da ist es keine schlechte Idee, sämtliche Färbungen, die im Labor durchgeführt werden, zu protokollieren und dabei für jede Färbung mehrere Protokolle mit leicht unterschiedlichen Zeiten zu berücksichtigen, sodass im konkreten Fall die geeignetste Variante gewählt werden kann. Auch können Kürzel verwendet werden, aus denen auf die jeweiligen Färbezeiten geschlossen werden kann. Es ist aber zu bedenken, dass sich der Pathologe bei der Diagnosestellung nur an dem orientieren kann, was er sieht.
Bei der Anpassung der Färbezeiten sollte man es sich nicht allzu kompliziert machen. Die folgenden Schritte funktionieren gut:
- Hämatoxylin ± 30 Sekunden
- Eosin Y ± 15 Sekunden
In der Regel ist es besser, jeweils nur eine Anpassung vorzunehmen. Die Zeiten sind gerade lang genug, um feine Veränderungen zu bewirken. Wenn grobe Änderungen notwendig sind, können größere Schritte gewählt werden. Wenn beispielsweise die Hämatoxylinfärbung viel zu schwach ist, verlängern Sie die Zeit ruhig um eine Minute oder mehr. Zur Feinjustierung allerdings bieten sich die oben genannten Zeiten an.
Denken Sie daran, dass die Anpassung einer Färbekomponente oft völlig ausreicht, um auch die andere besser darzustellen.
About the presenter

Cindy Sampias is a board certified Cyto- and Histo-technologist. With more than 25 years of experience, she is a guest speaker at histology and cytology meetings around the country. She is a technical author for Media Lab, publishing a variety of technical courses and sharing best practices in histology.
Related Content
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



