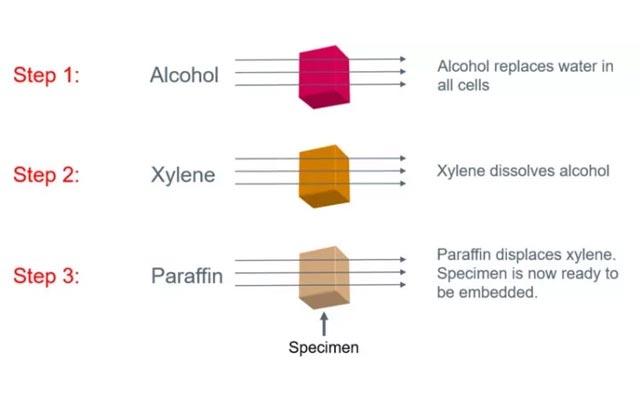
Der Fixierungsprozess und die Eigenschaften von Fixiermitteln

Das allgemeine Ziel der Fixierung besteht darin, Zellen und Gewebestrukturen in einem „lebensähnlichen Zustand“ zu erhalten, und zwar so, dass Dünnschnitte angefertigt und gefärbt werden können.1 Nichtsdestotrotz finden während der Fixierung und der nachfolgenden Schritte wesentliche Veränderungen im Gewebe statt. Diese betreffen u. a. die Zusammensetzung und das Aussehen der Zell- und Gewebekomponenten und haben mit einem „lebensähnlichen Zustand“ wirklich nicht mehr viel zu tun.
Die Bedeutung der Fixierung
Das allgemeine Ziel der Fixierung besteht darin, Zellen und Gewebestrukturen in einem „lebensähnlichen Zustand“ zu erhalten, und zwar so, dass Dünnschnitte angefertigt und gefärbt werden können.1 Nichtsdestotrotz finden während der Fixierung und der nachfolgenden Schritte wesentliche Veränderungen im Gewebe statt. Diese betreffen u. a. die Zusammensetzung und das Aussehen der Zell- und Gewebekomponenten und haben mit einem „lebensähnlichen Zustand“ wirklich nicht mehr viel zu tun. Dennoch ermöglicht es eine sorgfältige Fixierung, konsistente chemische und physikalische Merkmale in Gewebeschnitten zu erzeugen, in denen Muster, morphologische und biochemische Veränderungen beobachtet werden können, die wiederum einen Vergleich zu anderen Proben erlauben. Wenn man es so will, kann die Fixierung als „Momentaufnahme“ einer dynamischen, sich ständig verändernden Umgebung betrachtet werden. Der Punkt, an dem die Zeit angehalten wurde, ist der der Fixierung2, und wer sich das Bild genau ansieht, kann mit etwas Glück eine histopathologische Diagnose stellen.
Etwas wissenschaftlicher formuliert, zielt die Fixierung darauf ab, dem Fortschreiten degenerativer Prozesse entgegenzuwirken, die beginnen, sobald die Blutversorgung des Gewebes unterbrochen wird. Zum einen gilt es, die Autolyse zu verhindern, also die Verdauung des Gewebes durch intrazelluläre Enzyme, die frei werden, wenn die Membranen der Zellen und ihrer Organellen reißen. Aber auch Fäulnisprozesse durch bakterielle Zersetzung drohen, bis die Probe fixiert wird. Mikroorganismen sind in zahlreichen Proben präsent und bleiben aktiv, solange es die Bedingungen erlauben. Schließlich sollen auch der Verlust und die Diffusion von löslichen Substanzen verhindert werden. Dazu versucht man, sie auszufällen oder durch Vernetzung mit anderen unlöslichen Strukturen an Ort und Stelle zu halten. Zu berücksichtigen ist weiterhin, dass die Proben vor den schädlichen Auswirkungen der Gewebeinfiltration geschützt werden müssen, z. B. während der Exposition gegenüber heißem Wachs. Bei allem Schutz muss gewährt bleiben, dass das Gewebe seine Reaktivität zu Färbemitteln und anderen Reagenzien, einschließlich Antikörpern und Nukleinsäuresonden, nicht verliert.1,2
Es ist wichtig, sich bewusst zu machen, dass das Fixiermittel zunächst eine Reihe von Veränderungen im Gewebe hervorruft, was meist in einer wässrigen Umgebung geschieht. Es kann zur Schrumpfung, Schwellung und/oder Verhärtung einzelner Komponenten kommen. Später dann, nach dem Übertrag der Probe in eine nicht wässrige Umgebung und während der Infiltration, werden zusätzliche Veränderungen induziert, die die anfänglichen Effekte zum Teil aufheben.2 So verursacht die Fixierung in gepuffertem Formalin (10 %) zunächst eine leichte Schwellung des Gewebes. Während der Infiltration allerdings verliert die Probe etwa 20-30 % ihres Volumens.3 Das jeweils eingesetzte Fixiermittel hat zudem Einfluss darauf, inwiefern sich bestimmte Bestandteile der Probe mit verschiedenen histochemischen und immunhistochemischen Reagenzien anfärben lassen.4 Somit sollte die Gesamtwirkung eines bestimmten Fixiermittels auf Gewebe erst beurteilt werden, nachdem dieses infiltriert, geschnitten und gefärbt wurde.
Arten der Fixierung
Die Fixierung von Geweben kann chemisch oder physikalisch erfolgen. Physikalische Methoden umfassen Wärme- und Mikrowellenbehandlung sowie die Kryokonservierung. Die Wärmebehandlung empfiehlt sich für mikrobiologische Ausstriche, aber nicht für Gewebeproben und findet deshalb in Vorbereitung auf die Mikrotomie praktisch keine Anwendung. Die Mikrowellenfixierung allerdings, die durchaus als eine Form der Wärmefixierung angesehen werden kann, hat Einzug in viele Labore gehalten und findet breite Anwendung in Routinearbeiten. Sie wird in Teil 5 besprochen. Die Kryokonservierung wird in der Regel als Gefriertrocknung realisiert und hat ihre Daseinsberechtigung in der Histochemie, ist aber von geringerer Bedeutung für die Fixierung von Gewebeproben zur Diagnostik.2
Diesen Methoden gegenüber steht die chemische Fixierung, die normalerweise durch ein Eintauchen der Probe in das Fixiermittel (Immersionsfixierung) erfolgt. Wenn es darum geht, ganze Organe oder Labortiere zu konservieren, wird mitunter auch das Gefäßsystem genutzt, um eine Perfusion mit Fixiermittel (Perfusionsfixation) zu erreichen. Darüber hinaus gibt es Fixiermittel, die in Form von Dampf eingesetzt und für einige spezielle histochemische Verfahren verwendet werden. Paraformaldehyd und Osmiumtetroxid beispielsweise können zur Dampffixierung von gefriergetrocknetem Gewebe eingesetzt werden.
Fixierlösungen können ein einzelnes Fixiermittel enthalten, das in einem Lösungsmittel wie Wasser oder Alkohol oder häufiger in einer pH-stabilisierenden Pufferlösung gelöst ist. Einige beliebte Fixierlösungen hingegen enthalten eine Kombination aus verschiedenen Fixiermitteln. Der Grundgedanke dabei ist, dass die Mängel eines Mittels durch die Zugabe eines anderen kompensiert werden können. So gibt es mehrere Formulierungen, die Essigsäure enthalten, was der Schrumpfung entgegenwirken soll, die beispielsweise durch Ethanol verursacht wird.5
Theoretische Grundlagen der Fixierung
Die Fixierung kann als „eine komplexe Reihe chemischer Ereignisse“ betrachtet werden.6 Obwohl wir inzwischen in der Lage sind, einige dieser „Ereignisse“ zu definieren, so bleiben viele andere nach wie vor unverstanden. Zellen und extrazelluläre Strukturen enthalten Peptide und Proteine, Lipide und Phospholipide, Kohlenhydrate und Kohlenhydratkomplexe, verschiedene Arten von RNA und DNA und vieles mehr. Wie diese Elemente während der Fixierung reagieren und verändert werden, hängt von der Art der Fixierung, dem verwendeten Fixiermittel und den Fixierungsbedingungen ab. Einige Gewebeelemente gehen chemische Reaktionen mit dem Fixiermittel ein, werden durch Quervernetzung stabilisiert und somit konserviert. Andere wiederum bleiben vom Fixiermittel weitgehend unbeeinflusst, werden aber in der Zelle oder einem anderen Raum eingeschlossen, dessen Wände fixiert sind.
Klassifizierung der Fixiermittel und Wirkmechanismen
Traditionell wurden Fixiermittel aufgrund ihrer Wirkung auf lösliche Proteine in die Gruppen „koagulierend“ und „nicht koagulierend“ bzw. „vernetzend“ eingeteilt.7 Für koagulierende Fixiermittel wurde postuliert, dass sie ein permeables Netzwerk aus Proteinsträngen erzeugen. Nicht koagulierende Fixiermittel hingegen seien additiver Natur und führen zur massiven Quervernetzung und damit zur Bildung eines weniger durchlässigen Gels. Diese Begriffe finden sich auch in der moderneren histologischen Literatur, aber inzwischen wird ein systematischerer Ansatz zur Klassifizierung von Fixiermitteln bevorzugt.2
Es gibt zwei Hauptmechanismen, die bei der Fixierung von Proteinen und Proteinkomplexen wichtig sind: die Denaturierung sowie die Addition mit Bildung von Quervernetzungen.
Denaturierung: Dieser Effekt wird in der Regel durch dehydrierende Verbindungen wie Alkohole oder Aceton induziert. Diese Reagenzien verdrängen und ersetzen freies Wasser im Gewebe und modifizieren die Tertiärstruktur von Proteinen, indem sie bestimmte Bindungen schwächen. Hydrophobe Regionen, wie sie häufig im Inneren von Proteinmolekülen zu finden sind, werden aus der hydrophoben Wechselwirkung zum umgebenden Medium befreit und können sich neu und großflächiger ausrichten. In den hydrophilen Bereichen der Proteine sind Wassermoleküle über Wasserstoffbindungen lose gebunden; bei Verdrängung des Wassers werden diese Bindungen aufgehoben. Die Gesamtheit dieser Veränderungen in der Struktur des Proteins wirkt sich auf dessen Löslichkeit aus. Wasserlösliche Proteine werden unlöslich und weil es sich hierbei um einen irreversiblen Prozess handelt, gehen die Proteine auch nicht zurück in Lösung, wenn die Probe zu einem späteren Zeitpunkt in eine wässrige Umgebung überführt wird.2,7
Addition und Bildung von Quervernetzungen: Die nicht koagulierenden Fixiermittel reagieren chemisch mit Proteinen und anderen Zell- und Gewebekomponenten und binden an sie. Dadurch entstehen intra- und intermolekulare Quervernetzungen. Da es sich bei diesen Wirkstoffen um reaktive Verbindungen handelt, binden sie an eine Vielzahl funktioneller Gruppen, was deren Ladung beeinflussen kann. Daraus wiederum ergeben sich Konsequenzen für die Konformation des Moleküls und seine Löslichkeit, aber auch für die Färbung. Mit Formaldehyd fixiertes Gewebe beispielsweise lässt sich schlechter mit Eosin färben, weil das Fixiermittel in großem Umfang mit Aminogruppen reagiert und Methylenbrücken bildet. Damit sind diese Gruppen nicht mehr verfügbar, um negativ geladene Farbstoffmoleküle wie Eosin zu binden.
Das Ausmaß, in dem nicht koagulierende Fixiermittel Quervernetzungen bilden, variiert erheblich. So wirkt Glutaraldehyd wesentlich effektiver in der Bildung von Quervernetzungen als Formaldehyd.8 Das erklärt, warum es die Ultrastruktur der Zellen so gut bewahrt und das Fixiermittel der Wahl für die Elektronenmikroskopie ist. Es erklärt aber auch, warum glutaraldehydfixierte Gewebe mit herkömmlichen Methoden weniger gut anzufärben sind. Die chemischen Reaktionen, die der Gewebefixierung zugrunde liegen, sind für einige Wirkstoffe im Wesentlichen bekannt, z. B. für Formalaldehyd. In Bezug auf andere Wirkstoffe aber sind sie noch weitgehend unverstanden.
Verschiedene Methoden zur Antigendemaskierung, wie sie in der Immunhistochemie Anwendung finden, haben gezeigt, dass einige der Reaktionen, die während der Fixierung stattfinden, reversibel sind. Das gilt insbesondere für die von Formaldehyd. Es ist jedoch zu berücksichtigen, dass der Grad der Antigenkonservierung zwischen verschiedenen Wirkstoffen beträchtlich variiert. Die Bewahrung der Antigenität ist damit zu einem entscheidenden Faktor bei der Auswahl des Fixiermittels geworden.
About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Referenzen
- Drury RAB, Wallington EA. Carleton's histological technique. 5th ed. New York: Churchill Livingstone, 1980.
- Eltoum I, Fredenburgh J, Myers RB, Grizzle WE. Introduction to the theory and practice of fixation of tissues. J Histotechnol 2001;24;173 -190.
- Winsor L. Tissue processing. In Woods AE und Ellis RC eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.2-1 - 4.2-39.
- Williams JH, Mepham BL, Wright DH. Tissue preparation for immunocytochemistry. J Clin Pathol 1997;50;422-428.
- Leong AS-Y. Fixation and fixatives. In Woods AE und Ellis RC eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.1-1 - 4.1-26.
- Hopwood D. Fixation and fixatives. In Bancroft JD and Stevens A eds. Theory and practice of histological techniques. New York: Churchill Livingstone, 1996.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 1997.
- Pearse AGE. Histochemistry, theoretical and applied. London: Churchill Livingstone, 1980.
Related Content
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.