
Einfrieren biologischer Proben
In der Neurowissenschaft werden für gewöhnlich Hirnschnitte untersucht, die das gesamte Organ umfassen. Nur so lassen sich Details in Relation zu anderen Hirnregionen setzen. Um solche Schnitte erzeugen zu können, muss das Gewebe zunächst gehärtet werden, es sei denn, man nutzt ein viel langsamer arbeitendes Vibrationsmikrotom zur Schnitterstellung. Die Einbettung in Paraffin, wie sie für medizinische Proben regelmäßig Anwendung findet, eignet sich nur für ausreichend kleine und dünne Proben. Paraffin ist nicht in der Lage, ein gesamtes Mäuse- oder Rattenhirn zu durchdringen. Daher frieren Neurowissenschaftler ihre Hirnpräparate ein, um sie für die Mikrotomie zu härten.
Drei Formen festen Wassers
Beim Einfrieren werden die Zellmembranen beschädigt, was den histologischen Informationsgehalt biologischer Proben vermindert. Hier soll diskutiert werden, wie es zu dieser Membranschädigung kommt, welche Folgen sie hat und wie sie sich minimieren lässt, wenn Gewebeproben eingefroren werden müssen, um Dünnschnitte erstellen zu können.
Reines Wasser in festem Aggregatszustand kann drei Formen annehmen. Einerseits gibt es die beiden Formen von Eiskristallen, mit hexagonaler oder kubischer Anordnung. Wasser kann aber auch so schnell gefroren werden, dass es keine Zeit hat, Kristalle zu bilden, und amorph bleibt. Manchmal spricht man in diesem Zusammenhang auch von Glaswasser. Nun ist gemeinhin bekannt, dass sich Wasser beim Gefrieren ausdehnt. Dafür ist die Kristallbildung verantwortlich und tatsächlich handelt es sich um eine Eigenschaft, die man nur vom Wasser kennt. Daraus lässt sich ableiten, dass es bei der Bildung von amorphem Glaswasser nicht zur Ausdehnung kommt. Dies macht es zur einzig wünschenswerten Form gefrorenen Wassers für biologische Proben.
Die Einfriergeschwindigkeit macht den Unterschied
Die Ausdehnung des Wasservolumens beim Einfrieren überdehnt und zerstört die Membranen. Langsames Einfrieren fördert die Bildung von Eiskristallen und somit die Ausdehnung. Außerdem ist zu berücksichtigen, dass biologische Materialien schlechte thermische Leiter sind. Es ist daher wahrscheinlich, dass sich thermische Gradienten ausbilden, wenn die Probe eingefroren wird, und dass sich in einem beliebigen Gewebeabschnitt, der mehr als 10 mm von der Kältequelle entfernt ist, Eiskristalle formen. Wenn die Proben zum Gefrieren auf eine kalte Oberfläche gelegt werden, gefrieren sie langsam und mit hoher Wahrscheinlichkeit unter der Bildung von Kristallen, insbesondere in jenen Gewebeanteilen, die am weitesten von der Gefrierfläche entfernt sind. Langsam gefrorenes Gewebe mit ausgeprägter Kristallbildung zeigt bei der Erstellung von Gefrierschnitten den bekannten „Schweizer-Käse-Effekt“: Die Schnitte haben zahlreiche Löcher und Zellinhalte sind verloren, wobei die Stärke dieses Effekts vom Ausmaß der Kristallbildung abhängt.
Es sei noch einmal darauf hingewiesen, dass es nicht darum geht, die Proben auf eine möglichst niedrige Temperatur zu gefrieren, sondern sie möglichst schnell einzufrieren. Die Gefriergeschwindigkeit wiederum korreliert mit dem prozentualen Anteil der Probenoberfläche, die mit der Kältequelle in Kontakt ist, außerdem mit dem Wasservolumen, der Ausgangstemperatur der Probe und des in ihr enthalten Wassers und der Temperatur der Kältequelle. Im Idealfall ist die Kältequelle extrem kalt und so angeordnet, dass sie alle Oberflächen der Probe berührt.
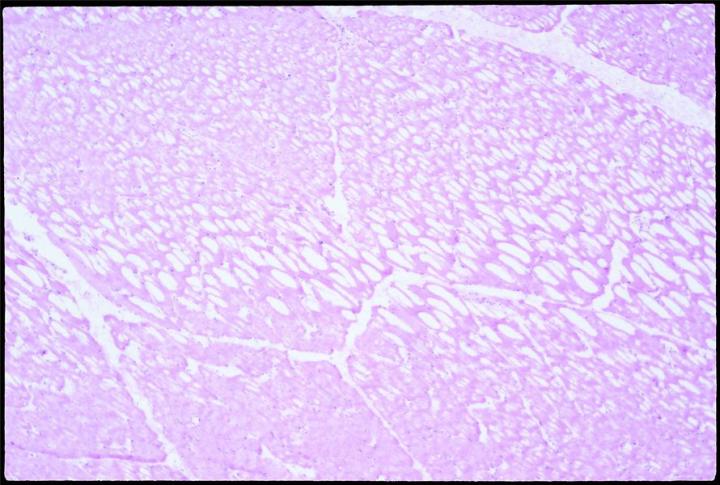
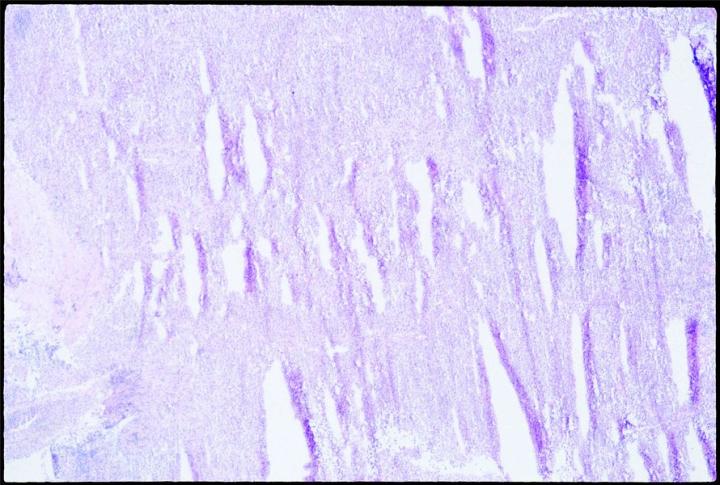

Proben so bald wie möglich schneiden
Selbst wenn das Gefrieren der Probe mit Bildung amorphen Glaswassers gelingt, ist das kein Dauerzustand. Glaswasser ist instabil. Bei Temperaturen über -121 °C beginnt eine Umstrukturierung des Glaswassers hin zu kubischen Eiskristallen, was zur Ausdehnung des Wassers führt. Bei über -80 °C schließlich werden aus kubischen Eiskristallen hexagonale Kristalle, die noch mehr Platz einnehmen. Zum Glück verlaufen diese Umstrukturierungsprozesse nur langsam, in Abhängigkeit vom Temperaturgradienten und der Reinheit des Wassers.
Für die meisten Anwendungen muss das Gewebe wieder über die Temperatur erwärmt werden, auf die es schockgekühlt wurde, um es schneiden zu können. Welche Temperatur dazu nötig ist, hängt vom Gewebetyp ab. Für das Gehirn können -9 bis -19 °C angenommen werden. Unterhalb dieser Temperatur ist es zu kalt, um geschnitten zu werden, und zersplittert unter dem Druck der Klinge wie extrem kaltes Eis unter unseren Füßen. Dabei entstehen Splittermarken, die parallel zur Klinge verlaufen und im finalen Präparat als Risse imponieren. Deshalb sollten Proben niemals geschnitten werden, bevor das Gewebe warm genug für die Mikrotomie ist. Auch sollten Proben nicht über Nacht oder sonstige längere Zeiträume in einem Kryostaten belassen werden, selbst wenn kein Auftauzyklus programmiert ist. Die Umwandlung von Glaswasser in hexagonale Kristalle findet trotzdem statt. Die Kristalle dehnen sich aus und beschädigen die Zellen und ihre Membranen.
Flüssiger Stickstoff
Das Eintauchen der Proben in eine ausreichend kalte Flüssigkeit sorgt für maximalen Oberflächenkontakt und ermöglicht deshalb ein besonders schnelles Einfrieren. Eine ebenfalls akzeptable Alternative besteht darin, das Gewebe auf vorgekühltem Metall zu platzieren und unverzüglich mit pulverisiertem Trockeneis zu bedecken, um den Oberflächenkontakt zu maximieren.
Flüssiger Stickstoff ist eine der kältesten Flüssigkeiten, die routinemäßig zur Verfügung stehen. Und er mischt sich nicht mit den Gewebekomponenten. Das macht ihn offensichtlich zu einem idealen Einfriermedium. Flüssiger Stickstoff hat jedoch eine sehr niedrige spezifische Wärmekapazität. Daraus folgt, dass es an der Kontaktstelle zu wärmerem Gewebe, selbst wenn es nur ein winziger Teil der Probe ist, sofort zu sieden beginnt. Dabei kann sich eine Dampfbarriere bilden, eine Schicht aus gasförmigem Stickstoff, die das Gewebe umgibt und es gegenüber dem kalten, flüssigen Stickstoff isoliert. Dadurch wird der Gefrierprozess verlangsamt und insgesamt nur schwer vorhersehbar. In der Praxis bedeutet das, dass die äußeren Gewebeschichten meist optimal und unter Bildung von Glaswasser gefroren werden, sich dann aber die eben beschriebene Dampfbarriere aufbaut, die das Einfrieren des Probeninneren wesentlich verzögert. Innerhalb der gefrorenen Schale bilden sich dann Kristalle, die den gesamten Block sprengen. Ein derart rissiger Block weist also darauf hin, dass zumindest die innersten Gewebeanteile unter Kristallbildung gefroren sind. Dieses Problem betrifft ausschließlich großvolumige Gewebeblöcke, beispielsweise ganze Hirne von Maus und Ratte. Flüssiger Stickstoff eignet sich hingegen sehr gut zum Gefrieren von Bioptaten und kleineren Proben und wird in klinischen Laboren entsprechend verwendet.
Alternative Lösungen
Verschiedene andere Flüssigkeiten ermöglichen ein zuverlässigeres Gefrieren größerer Blöcke, insbesondere Isopentan, das auf -80 °C gekühlt wurde. Es bildet keine Dampfbarriere und lässt Proben, die wenig mehr als einen Kubikzentimeter groß sind, in ihrer Gesamtheit unter Bildung von Glaswasser gefrieren. Für maximalen Oberflächenkontakt ist ein vollständiges Eintauchen in die Flüssigkeit notwendig; das Gewebe wird dabei nicht beschädigt. Es empfiehlt sich, die Probe in der Flüssigkeit zu bewegen.
Eine weitere Lösung besteht darin, das Gewebe mit Glycerin, Polyethylenglykol (Frostschutzmittel), Glycerol oder Saccharoselösungen zu durchsetzen. Diese stören die Kristallbildung und senken die Gefriertemperatur. Phosphatgepufferte Saccharose (30 %) wird in diesem Zusammenhang am häufigsten verwendet, eignet sich aber nur zur Behandlung gut fixierten Gewebes, da unfixiertes Gewebe aufgrund der Osmolarität der Lösung schrumpfen würde.
About the presenter
Referenzen
- Jongebloed WL, Stokroos, D, Kalicharan D, van der Want JJL. Is Cryopreservation Superior Over Tannic Acid/Arginine/Osmium Tetroxide non-Coating Preparation in Field Emission Scanning Electron Microscopy? Scanning Microscopy 1999;13;93-109.
- Reid N, Beesley J. Practical Methods in Electron Microscopy: Sectioning and Cryosectioning for Electron Microscopy. 13th ed. Amsterdam: Elsevier, 1991.
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.
