
고정과 조직 처리가 면역세포화학(면역염색, IHC)에 미치는 영향
조직 검체 고정제로서 포름알데히드의 첫 사용법들 중 하나는 19세기 말 블룸 박사 (Dr. F. Blum)에 의해 우연히 발견되었습니다. 블룸 박사는 병리학자는 아니었지만 세균학에 관심이 있었습니다. 그 박사님은 화학회사로부터 신제품을 소독제 (포름알데히드 용액)로서 평가해달라는 요청을 받았을 때, 4% 수용액을 만들기 위해 1:10으로 희석하였고 그 용액이 좋지만 느리게 작용하는 살균제라는 것을 발견했습니다. 그는 또한 용액이 짧은 시간 동안 손가락에 남아있으면 딱딱해진다는 것을 주목하였습니다. 이 딱딱함은 그가 알코올과 같은 다른 고정제들과 경험했던 것과 같은 종류의 딱딱함이 였습니다. 블룸의 관찰에 기반하여 이 4% 용액은 포름알데히드 고정을 위해 권장되는 비율로 남았으며, 이 비율은 포르말린 고정이 조직 면역 반응성에 미치는 해로운 영향이 잘 문서화되었음에도 불구하고 이의가 제기되지 않았습니다!
그러나 파라핀 처리와 헤마톡실린-에오신 염색 후 현미경으로 보이는 모습의 일관성 관점에서 포르말린 고정은 지난 세기 동안 병리학자의 선택이 되어 왔습니다. 병리학자들은 포르말린으로 고정된 조직 검체를 해석하는 훈련이 되어 있고, 이를 바꾸는 것은 조직 형태학에 변화를 일으키고 진단에 문제를 일으킬 수 있습니다. 진단에서 면역세포화학의 사용이 증가함에 따라, 만약 항원 복구 기술이 개발되지 않았더라면 포르말린으로 고정된 파라핀 처리 조직들에서의 감소한 면역 인지로 인한 문제가 고정제 선택에 변화를 가져왔을 수도 있습니다.
면역 반응성
면역세포화학자들의 주요 목표는 특이도를 훼손하지 않으면서 최대한의 민감도를 얻을 수 있는 프로토콜을 고안하는 것입니다. 조직 고정은 1차 항체의 특이도에 막대한 영향을 미치고, 면역세포화학법의 민감도에 가장 큰 영향을 미칩니다.
고정 자체만으로는 특징적으로 조직 항원의 면역 인지 상실을 일으키지는 않습니다. 일부 항원에 대한 면역 인식은 특정 고정의 조합, 조직 처리, 파라핀 포매 과정에서 상실됩니다. 동결 절편에 사용된 고정제로 표현된 항원은 동일한 고정제의 사용 후 추가적으로 조직 처리와 파라핀 포매 및 파라핀 절편 제작이 진행된 후에는 동일한 항체가 두 염색 과정에 사용되었다 하더라도 표현되지 않을 수 있습니다.
포름알데히드는 조직 고분자를 변성 시켜 대부분의 조직 항원들을 구성하는 조직 단백질들이 면역세포화학에 사용되는 1차 항체에 접근할 수 없게 합니다 (항원 회피). 알데하이드 유도 교차결합은 고온 에서 가열하거나 강한 알칼리성으로 처리함으로써 역전될 수 있습니다. 쉬(Shi)는 관련 논문에서1 이러한 기법들을 조직 절편에 적용하였고 중금속 용액에 담그고 전자레인지에 가열한 절편의 전처리가 면역세포화학 기법의 민감도를 높인다는 것을 보여줬습니다. 이러한 기법을 “항원 복원” 법으로 명명하였고 그 이후로 압력솥, 오토클레이브(고압 처리기), 찜통, 중탕기 등을 포함한 여러 가열 장치들이 유사한 효과를 달성하는 것으로 보고됩니다. “열처리에 의한 항원성 복원(heat induced epitope retrieval , HIER)” 이란 용어는 널리 받아들여진 서술 용어가 되었습니다. HIER 이전에는 단백질 분해 효소의 사용이2 포르말린 고정의 항원 회피 효과를 역전시키는 가장 일반적인 접근법이었습니다 (EIER). 단백질 분해 효소와 농도, 그리고 소화 기간의 선택은 대체로 실증을 기반으로 합니다. 하지만 광범위한 효소를 사용하기보다는 적절하게 선택하는 효소의 사용을 최적화하는 것이 중요합니다.
요약
모든 좋은 조직학적 작업의 기초는 적절한 고정과 양질의 조직 처리이다. 최근 조직학적 진단을 위한 검체 소요 시간을 줄이려는 실험실에 대한 요구는 흔히 검체가 포르말린에 고정되어야 하는 시간을 단축하는 결과를 초래합니다.
부실하거나 부적절한 고정은 부실한 파라핀 포매로 이어지고, 이는 불량한 품질의 파라핀 절편으로 이어집니다. 불량하게 처리된 조직 블록에서 잘린 절편은 항원 복원 기법에서도 형태가 손상되고 항원은 손실되거나 분산될 수 있습니다.
포르말린 고정과 연관된 문제에도 불구하고 고품질의 면역 염색을 얻기 원한다면 기본적인 조직학 기법의 이러한 측면의 중요성이 결코 절충되면 안됩니다.
그림
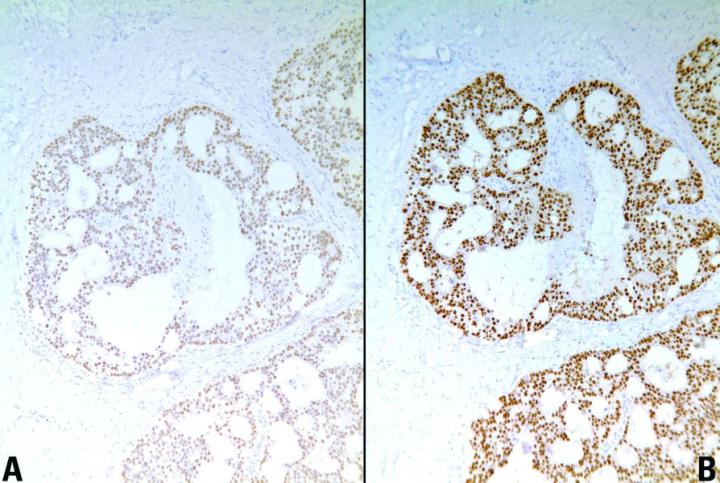
효소 소화의 주요 factor
다음은 효소 소화의 주요 factor 입니다.
- 온도
- pH(산도)
- 효소 농도
- 소화 지속 시간
최적의 면역세포화학 염색을 위해 소화 시간은 대단히 중요하며 이는 포름알데히드 고정 시간에 달려 있습니다. 포르말린에 오랜 시간 고정된 조직은 보통 단백질 분해 효소에 장기적인 노출이 필요합니다. 배치마다 효소 활성도의 차이 때문에 소화 시간이 다를 수 있습니다. 효소 항원 복원의 또 다른 단점은 잘 고정되지 않은 조직은 과도하게 소화되기 쉬워 형태학적 요소들의 손실을 일으킬 수 있다는 점입니다.
참조된 조직 블록 및 절편의 사례와 같이 고정과 파라핀 처리 스케줄을 모르는 경우에는 최적의 면역세포화학 결과를 얻기 위해서 여러 범위의 소화 시간을 시행해야 할 수도 있습니다.
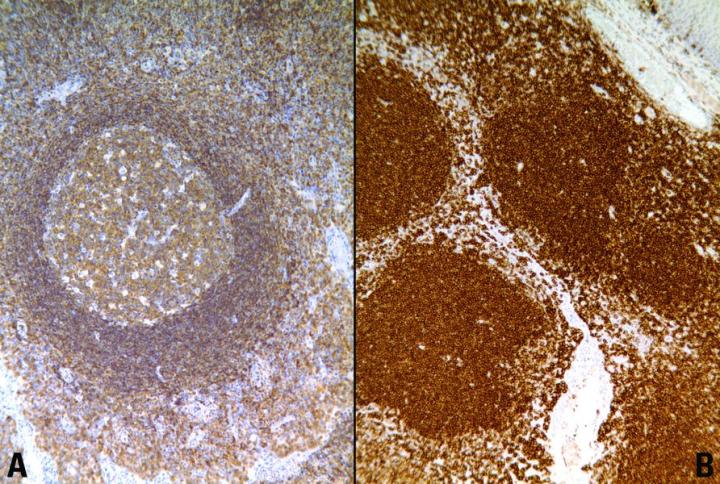
HIER에는 여러 가지 장단점이 있습니다. 주요 장점은 항원을 복원하기 위한 가열 시간이 고정 시간과 관계없이 표준화되어 있다는 점입니다. 그리고 그 밖에 다음과 같은 장점들도 있습니다
- 높은 염색 강도
- 포르말린으로 고정된 조직에서 일반적으로 보이지 않는 항원의 관찰
- 포르말린 민감 조직 항원의 일관되고 신뢰할 수 있는 고품질의 면역 염색.
기본 절차의 표준화
면역염색에 앞서 고정, 조직 처리, 조직 절편의 처리와 같이 조직 병리에 사용되는 기본 절차들의 표준화는 실험실 성과를 향상하는데 크게 기여하게 될 것이다. 하지만 조직 처리는 표준화와는 거리가 멉니다. 사용되는 고정제(예, NBF이나 포르말린 용액)의 제조법이나 포르말린 칼슘 등과 같은 다른 포르말린 용액의 사용은 전통적으로 각각의 개별 실험실에서 결정했습니다. 조직 처리 시약과 조직 처리 시간의 선택도 마찬가지입니다. 조직학의 근본적인 과정에 있어 이러한 표준화의 부족은 결국 특정 조직에 대한 특유의 표본을 제작합니다. 그 후 그러한 블록으로부터 잘린 절편들은 다른 곳에서 고정하고, 가공되고, 잘린 물질로부터 제작된 절편과는 크게 다른 면역조직화학적 검사 결과를 제공할 수 있습니다. 그러한 물질을 다루는 데 있어 실험실 관계자들이 참고 물질과 관련된 문제들과 위험성에 대해 이해하고 있는 것이 필수적이며, 높은 품질의 면역염색을 만들기 위해 확립된 프로토콜 방법을 완전하게 숙지하고 있어야만 합니다.
성공적인 면역세포화학은 몇 가지 기술적 매개 변수들의 정확한 통합으로 이뤄진다고 볼 수 있다. 면역세포화학의 목적은 조직 구조의 온전함을 보존하는 동시에 최소한의 배경 염색으로 항원을 재현할 수 있고 일관되게 나타내는 방법을 달성하는 것입니다. 고정과 뒤따르는 파라핀 처리는 필수적인 고려 사항입니다.
"성공적인 면역세포화학은 몇 가지 기술적 매개 변수들의 정확한 통합으로 이뤄진다고 볼 수 있다. 면역세포화학의 목적은 조직 구조의 온전함을 보존하는 동시에 최소한의 배경 염색으로 항원을 재현할 수 있고 일관되게 나타내는 방법을 달성하는 것입니다. 고정과 뒤따르는 파라핀 처리는 필수적인 고려 사항입니다. 충분하고 적절한 고정은 모든 조직학적 그리고 면역세포화학적 표본 제작의 초석입니다. 이상적인 고정은 좋은 형태학과 좋은 항원성 사이의 균형입니다. 부실한 고정이나 고정의 지연은 항원성의 상실 또는 주변 조직으로 항원의 확산을 유발합니다. 잘 고정되지 않은 블록은 파라핀이 충분히 침투되지 않습니다. 조직 처리 탈수 단계에서 사용되는 알코올은 훌륭한 고정제이자 훌륭한 탈수제입니다. 그러나, 잘 고정되지 않은 조직 블록에서와 마찬가지로, 고정제와 탈수제로서 둘 다 수행하도록 요청한다면 어느 한쪽도 달성하지 못하게 되고, 제대로 처리되지 못합니다. 따라서 왁스가 부적절하게 스며든 블록이 생성 됩니다. 그러나 이러한 경우에 재처리가 시행되면 모든 것이 손실되지 않을 수 있고, 대부분의 항원에 대해 합리적인 면역세포화학 염색이 이뤄질 수 있습니다.
미국병리학회(The College of American Pathologists, ASCO-CAP 가이드라인)는 미국에서 유방 조직 고정의 표준화를 다루기 위해 노력해왔습니다. 그들의 권고는 조직을 NBF에서 최소 6시간에서 최대 48시간 고정하는 것입니다3. 중성 완충 포르말린은 한 달 이내에 만든 것이어야 합니다. 파라핀으로 즉시 처리할 수 없는 고정된 조직은 처리될 때까지 70% 알코올에 보관되어야 합니다. 현재까지 영국서에는 고정제의 종류나 고정 시간에 대한 공식적인 권고는 존재하지 않습니다. 2003년 골드스타인 연구진(Goldstein et al)이 시행한 연구4는 유방 생검, 중심부 바늘 생검, 그리고 절제 검체가 6~9시간 미만으로 고정된 경우 에스트로겐 수용체 위음성의 면역세포화학 결과가 나타날 수 있음을 보여줬습니다. 따라서 일반적으로 같은 날에 검체를 파라핀 처리까지 하기 위해 서두르기보다는 하룻밤 사이에 조직을 고정하는 것이 가장 좋다고 여겨집니다. 사용하는 고정제의 양은 이상적으로 고정할 조직 부피의 15~20배 정도가 되어야 합니다. 절편을 위해 선택된 조직은 적절한 시간 동안 충분히 고정될 수 있도록 얇아야 합니다. 조직의 부피는 필요한 고정제의 용량을 결정하고 검체의 두께는 고정의 속도를 결정합니다.
1차 항체의 최적 희석배율
면역세포화학을 위한 1차 항체의 최적 희석배율은 최소한의 배경 염색과 최적의 특정 항원 염색을 도와주는 1차 항체의 농도입니다. 최적 희석배율은 고정제의 종류와 고정 시간에 따라 달라집니다. 그러므로 개별 실험실에서 선호하는 면역세포화학 검출 시스템을 사용할 때 최상의 결과를 제공하는 1차 항체의 희석배율을 찾는 것이 가장 중요합니다. 따라서 각 연구실이 동일한 면역세포화학 방법을 사용함에도 불구하고 동일한 1차 항체 희석배율을 사용하는 것은 드문 일입니다.
참조 문헌
- Shi SR, Key ME, Kalra KL. Antigen retrieval in formalin-fixed, paraffin embedded tissue: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. J Histochem Cytochem 39:741-748 1991.
- Huang SN, Minassian H, More JD. Application of immunofluorescent staining on paraffin sections improved by trypsin digestion. Lab Invest 35:383-390 1976.
- Wolff AC, Hammond ME, Schwartz JN, Hagerty KL, Allred CD, Cote RJ et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. Clin Oncol. Jan 1;25(1):118-45. 2007.
- Goldstein NS, Ferkowicz MT, Odish E, Mani A, Hastah F. Minimum formalin fixation time for consistent estrogen receptor immunohistochemical staining of invasive breast carcinoma. Am J Clin Pathol 120:86-93 2003.
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.
