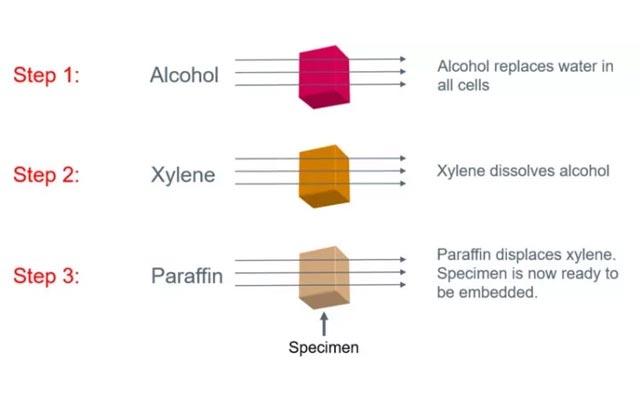
Proceso de fijación y naturaleza de los fijadores

El objetivo general de la fijación tisular es preservar las células y los componentes tisulares en un “estado lo más realista posible” y hacerlo de tal manera que permita la preparación de secciones finas y teñidas. Por supuesto, durante la fijación y los pasos que siguen se producen cambios sustanciales en la composición y el aspecto de los componentes celulares y tisulares, y estos están muy alejados de preservar un ideal "estado lo más realista posible".
La importancia de la fijación
El objetivo general de la fijación tisular es preservar las células y los componentes tisulares en un “estado lo más realista posible” y hacerlo de tal manera que permita la preparación de secciones finas y teñidas. 1 Por supuesto, durante la fijación y los pasos que siguen se producen cambios sustanciales en la composición y el aspecto de los componentes celulares y tisulares, y estos están muy alejados de preservar un ideal "estado lo más realista posible". Sin embargo, con cuidado, podemos producir características químicas y físicas uniformes en secciones de tejido que permitan observar patrones, observar cambios morfológicos y químicos y realizar comparaciones. Estas observaciones nos permiten ver un entorno dinámico en constante cambio “fijado” en un momento determinado en el tiempo 2 y pueden permitir la realización de un diagnóstico histopatológico.
Con fines prácticos, la fijación tiene como objetivo prevenir o detener los procesos degenerativos que comienzan en cuanto un tejido es privado de su riego sanguíneo. La autolisis, que da lugar a la digestión tisular por parte de las enzimas intracelulares liberadas cuando se rompen las membranas de los orgánulos, y la descomposición bacteriana o putrefacción producida por microorganismos que pueden estar ya presentes en la muestra, son procesos que deben prevenirse. La pérdida y difusión de sustancias solubles debe evitarse en la medida de lo posible mediante la precipitación o la coagulación de estos componentes o su reticulación con otros componentes estructurales insolubles. Los tejidos deben protegerse en gran medida contra los efectos perjudiciales del procesamiento de tejidos, incluida la infiltración con cera caliente, pero, lo que es más importante, los tejidos deben conservar la reactividad a las tinciones y otros reactivos, incluidos los anticuerpos y las sondas de ácido nucleico.1,2
Es importante darse cuenta de que un fijador producirá inicialmente una serie de cambios en los tejidos en lo que normalmente es un entorno acuoso. Estos incluirán la contracción, la hinchazón y el endurecimiento de varios componentes. A pesar de estos efectos iniciales, los tejidos sufrirán más cambios durante el procesamiento cuando se coloquen en un entorno no acuoso. 2 Por ejemplo, la fijación en formol tamponado al 10 % provoca inicialmente una ligera hinchazón de las muestras de tejido. Sin embargo, durante el procesamiento, la muestra puede encogerse entre un 20 % y un 30 % de su volumen.3 El fijador particular empleado también influirá en el grado en que los elementos individuales se teñirán con diversos reactivos histoquímicos e inmunohistoquímicos.4 Por lo tanto, el efecto total sobre los tejidos de un fijador particular debe evaluarse después de que un tejido se haya procesado, seccionado y teñido para demostrar los elementos necesarios.
Tipos de fijación
La fijación de tejidos se puede lograr por medios químicos o físicos. Los métodos físicos incluyen el calor, las microondas y la criopreservación (liofilización por congelación). La fijación por calor rara vez se utiliza en muestras de tejido, su aplicación se limita a frotis de microorganismos. Sin embargo, hoy en día, la fijación por microondas, que puede considerarse una forma de fijación por calor, se practica ampliamente en laboratorios de rutina y se tratará en la Parte 5. La criopreservación, normalmente en forma de liofilización por congelación, tiene algunas aplicaciones en histoquímica, pero normalmente no se aplica a muestras de tejido de diagnóstico.2
La fijación química normalmente se logra sumergiendo la muestra en el fijador (fijación por inmersión) o, en el caso de animales pequeños o algunos órganos completos, como un pulmón, perfundiendo el sistema vascular con fijador (fijación por perfusión). Para algunos procedimientos histoquímicos especializados, los fijadores se han aplicado ocasionalmente en forma de vapor. Por ejemplo, el paraformaldehído y el tetraóxido de osmio pueden usarse para fijar por vapor tejidos liofilizados por congelación.
Las soluciones de fijadores pueden contener un único agente fijador disuelto en un disolvente tal como agua o alcohol o, más comúnmente, una solución tampón para estabilizar el pH. Algunas soluciones de fijadores populares contienen varios agentes fijadores diferentes en combinación debido a que los defectos de un agente pueden compensarse mediante la adición de otro. Por ejemplo, el ácido acético está presente en algunas formulaciones para contrarrestar la contracción causada por otros agentes como el etanol.5
Base teórica de la fijación
La fijación puede considerarse “una serie compleja de acontecimientos químicos”.6 Aunque ahora podemos definir algunos de estos “eventos”, nuestra comprensión de gran parte de lo que sucede durante la fijación sigue siendo incompleta. Las células y los componentes extracelulares contienen péptidos y proteínas, lípidos y fosfolípidos (membranas), carbohidratos y complejos de carbohidratos, varios tipos de ARN y ADN, etc. La reacción de estos elementos durante la fijación dependerá del tipo de fijación, del agente de fijación utilizado y de las condiciones de fijación. Algunos elementos tisulares reaccionarán químicamente con el fijador, se estabilizarán mediante reticulación y, por tanto, se conservarán; otros pueden no verse afectados por el fijador, pero sí quedar atrapados dentro de una célula o tejido por otros elementos fijados.
Clasificación de los agentes de fijación y los mecanismos de fijación
Tradicionalmente, los agentes de fijación se denominaban “coagulantes” o “no coagulantes” con base en su efecto sobre las proteínas solubles en la solución.7 Se dijo que los fijadores coagulantes resultan en una malla permeable de hebras proteicas, mientras que los fijadores no coagulantes que son de naturaleza aditiva, formaron enlaces cruzados extensos que producen un gel menos permeable. Estos términos todavía se encuentran en la literatura histológica moderna, pero recientemente se ha adoptado un enfoque más sistemático para la clasificación.2
Hay dos mecanismos principales que son importantes en la fijación de proteínas y complejos proteicos: la desnaturalización, la adición y la formación de enlaces cruzados.
Desnaturalización:Con mayor frecuencia, este efecto es inducido por deshidratantes como los alcoholes o la acetona. Estos reactivos eliminan y sustituyen el agua libre en células y tejidos y provocan un cambio en la estructura terciaria de las proteínas mediante la desestabilización de los enlaces hidrofóbicos. Las áreas hidrófobas, que suelen encontrarse en el interior de las moléculas proteínicas, se liberan de la repulsión del agua y quedan libres para ocupar una zona mayor. En las áreas hidrófilas de las proteínas, las moléculas de agua están unidas débilmente por enlaces de hidrógeno y la eliminación del agua también desestabiliza estas uniones. Los cambios producidos en la conformación de las moléculas de proteína provocan un cambio en la solubilidad de la proteína, lo que hace que las proteínas solubles en agua sean insolubles, un cambio que es en gran medida irreversible si la proteína se devuelve a un entorno acuoso. 2, 7
Adición y formación de enlaces cruzados: Los agentes de fijación no coagulantes reaccionan químicamente con proteínas y otros componentes celulares y tisulares, y se unen a ellos mediante adición y forman enlaces cruzados inter e intramoleculares. Debido a que estos agentes son compuestos reactivos, se unen a diversos grupos químicos en los tejidos, y a menudo afectan a la carga en el lugar de unión. Esto puede tener un efecto sobre las características de tinción posteriores de una proteína particular, así como también alterar su conformación molecular y, por lo tanto, su solubilidad. Por ejemplo, el tejido fijado con formaldehído se tiñe de forma deficiente con la eosina porque el formaldehído reacciona ampliamente con los grupos aminos para formar puentes de metileno y, por lo tanto, estos grupos dejan de estar disponibles para unirse a moléculas de colorante con carga negativa como las de eosina.
La medida en que los fijadores aditivos forman enlaces cruzados varía considerablemente. Por ejemplo, el glutaraldehído es más efectivo para formar enlaces cruzados que el formaldehído.8 Esto explica por qué preserva de forma tan efectiva la ultraestructura de las células y es el fijador preferido para la microscopía electrónica. También explica por qué los tejidos fijados con glutaraldehído se tiñen mal con métodos convencionales de tinción. Las reacciones químicas de la fijación tisular se comprenden bastante bien en el caso de algunos agentes como el formaldehído, pero nuestro conocimiento de los mecanismos implicados con otros agentes es incompleto.
Los métodos de recuperación de antígenos en inmunohistoquímica han demostrado que algunas de las reacciones de fijación son reversibles, especialmente las de formaldehído, pero hay una variación considerable en la calidad de la conservación de antígenos con diversos agentes. La conservación de la antigenicidad se ha convertido en una consideración muy importante a la hora de elegir un fijador.
About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Referencias
- Drury RAB, Wallington EA. Carleton's histological technique. 5th ed. New York: Churchill Livingstone, 1980.
- Eltoum I, Fredenburgh J, Myers RB, Grizzle WE. Introduction to the theory and practice of fixation of tissues. J Histotechnol 2001;24;173 -190.
- Winsor L. Tissue processing. In Woods A and Ellis R eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.2-1 - 4.2-39.
- Williams JH, Mepham BL, Wright DH. Tissue preparation for immunocytochemistry. J Clin Pathol 1997;50;422-428.
- Leong AS-Y. Fixation and fixatives. In Woods AE and Ellis RC eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.1-1 - 4.1-26.
- Hopwood D. Fixation and fixatives. In Bancroft J and Stevens A eds. Theory and practice of histological techniques. New York: Churchill Livingstone, 1996.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 1997.
- Pearse AGE. Histochemistry, theoretical and applied. Londres: Churchill Livingstone, 1980
Related Content
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.