
Descripción general de la tinción con H&E: Una guía de mejores prácticas


Para el diagnóstico rutinario, los patólogos prefieren de lejos el uso de hematoxilina y eosina (H&E) para ver los detalles de la estructura celular y tisular. La variación de la intensidad de la tinción a menudo viene determinada por la experiencia de aprendizaje y las preferencias personales del patólogo. Debido a que esta tinción demuestra una gama tan amplia de características citoplásmicas, nucleares y de matriz extracelular, casi todos los textos didácticos utilizan imágenes de H&E. Hoy en día seguimos utilizando esta simple y esencial tinción, que ha permanecido sin cambios durante más de un siglo.
El procedimiento de tinción H&E sigue un protocolo básico:
- Desparafinado
- Deshidratación
- Hematoxilina
- Diferenciación
- Azulado
- Eosina
- Deshidratación
- Aclaramiento
- Montaje
El formato se reproduce fácilmente y los reactivos son lo suficientemente resistentes como para permitir la tinción uniforme de grandes cantidades de preparaciones antes de tener que cambiar los reactivos.
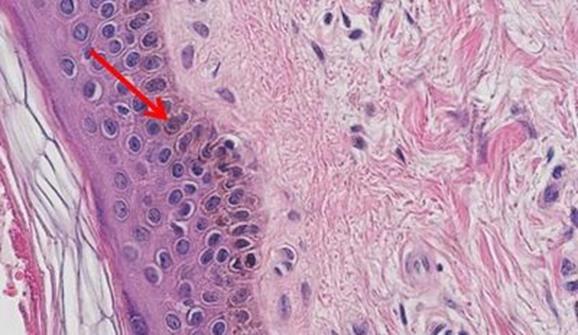
En el pasado, las tinciones y sus componentes se fabricaban de forma rutinaria en el laboratorio. Los reactivos prefabricados y disponibles comercialmente eran poco frecuentes y caros. Por lo tanto, como forma económica de realizar este tipo de tinción, los técnicos aprendieron a fabricar los tintes según era necesario. El reto era asegurarse de que la calidad de la tinción fuera uniforme. Los diferentes técnicos siguen las recetas utilizando su propio enfoque individual, por lo que la fabricación de tintes normalmente se deja a cargo de una persona. Dicho esto, también había más técnicos en el laboratorio, por lo que el tiempo necesario para preparar los reactivos no afectaba la carga de trabajo general del equipo.
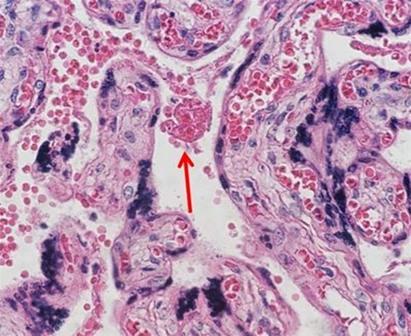
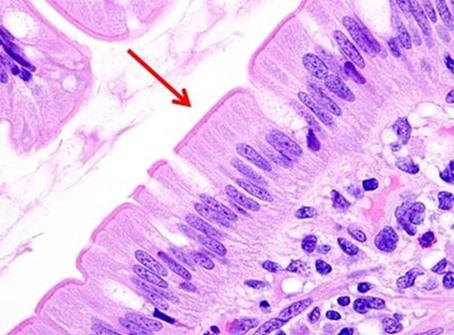
Muchos laboratorios consideran que pedir las tinciones es la forma más sencilla de garantizar una calidad uniforme y repetible. Una gran variedad de combinaciones de tinción de hematoxilina y eosina proporcionan la capacidad de personalizar los resultados deseados con muy poco esfuerzo. A medida que más técnicos se jubilan y las empresas se vuelven más eficientes, la reducción de personal hace que el uso de reactivos disponibles comercialmente sea ideal porque los técnicos pueden centrarse en la inclusión y el corte, que son las áreas del laboratorio que cuentan con la menor automatización.
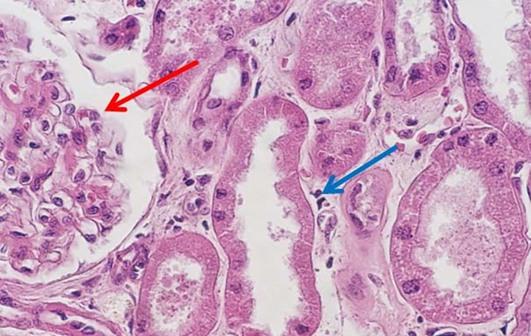
Para los nuevos profesionales que entran en el campo de la histología, los días de fabricación de reactivos se están convirtiendo rápidamente en algo del pasado. Creo que este cambio puede ser problemático, principalmente porque parte del arte que es típicamente histología se pierde. Uno de mis desafíos personales al trabajar con estudiantes es ayudarles a solucionar anomalías de tinción. Cuando el laboratorio realiza tinciones, el equipo aprende de la experiencia práctica, lo que ocurre cuando falta un componente o se añade un componente incorrecto a la mezcla. Estos cambios pueden hacer alteraciones sutiles en las preparaciones teñidas, lo que se espera que el equipo de histología arregle en última instancia. Por último, los equipos de histología más nuevos pueden tener dificultades a la hora de abordar estos cambios sutiles de fácil arreglo, sin tener la experiencia de producir reactivos y las lecciones aprendidas en ese proceso.
¿Qué contiene una tinción H&E?
Las tinciones de hematoxilina y eosina se utilizan en muchas áreas del laboratorio de histología, incluidas secciones congeladas, aspiraciones con aguja fina y tejidos incluidos fijados en parafina. Para comprender mejor cómo debe ser una preparación bien teñida, es importante comprender los componentes de la tinción.
La hematoxilina se utiliza para ilustrar los detalles nucleares en las células. La profundidad de la coloración no solo está relacionada con la cantidad de ADN en los núcleos, sino también con el tiempo durante el que la muestra se deje en hematoxilina.
La hematoxilina es un colorante razonablemente simple de preparar. El propio colorante se extrae del árbol Haematoxylon campechianum. La oxidación de la hematoxilina produce hemateína, que es el colorante utilizado en una tinción H&E. La adición del mordiente mejora la capacidad de la hemateína para unirse a los componentes aniónicos (cargados negativamente) de los tejidos.
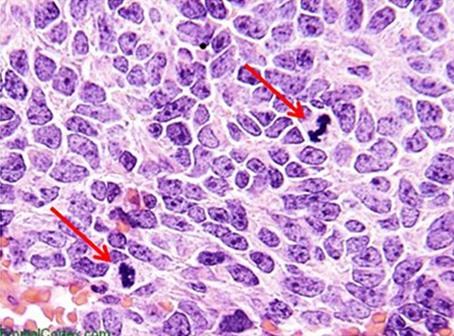
Las hematoxilinas se clasifican típicamente según el mordiente utilizado antes de la tinción. Los mordientes refuerzan la carga iónica positiva de la hematina. Esto ayuda a la unión de la hematina al componente de tejido aniónico, que es la cromatina más común. El tipo de mordiente también influye en el color final de los componentes teñidos. El mordiente más común utilizado en la histología de rutina es el sulfato de aluminio y amonio (alum). Este mordiente hace que los núcleos se vean de color rojo, que luego cambia al azul más familiar cuando la muestra se enjuaga posteriormente con una solución débilmente básica.
La hematoxilina de Mayer es una hematoxilina alumínica, una tinción de uso común que puede emplearse para tinciones progresivas y regresivas. Se utiliza a menudo como contratinción nuclear para tinciones especiales e inmunohistoquímica. Para estas aplicaciones, la solución de Mayer se utiliza para teñir los núcleos y luego teñir de azul sin utilizar un diferenciador. La de Mayer es una tinción a base de agua.
La hematoxilina de Harris es otra hematoxilina alumínica de uso frecuente que puede utilizarse para la tinción progresiva de muestras citológicas, pero también para la tinción progresiva o regresiva en histología. La tinción tiende a proporcionar detalles nucleares claros. Uno de los retos al utilizar Harris es que se diferencia mejor con un ácido suave, en lugar de los diferenciadores a base de ácido clorhídrico más utilizados. Harris es una tinción a base de alcohol. La hematoxilina de Gill es una hematoxilina alumínica. Puede utilizarse como tinción progresiva o regresiva y está disponible en diferentes concentraciones. Debido a que se fabrica con agua y etilenglicol, la autooxidación de la tinción se evita normalmente durante meses, lo que la hace más estable que la hematoxilina de Harris. Sin embargo, la naturaleza de la de Gills hace que pueda producirse tinción extranuclear. La mucina e incluso los adhesivos utilizados en la preparación pueden contaminarse con Gills.
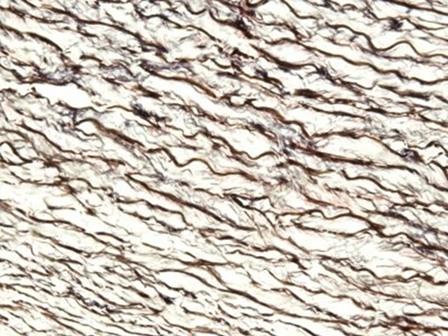
Las hematoxilinas que utilizan sales de hierro como mordiente se utilizan normalmente en tinciones especiales. Esto se debe a que pueden mostrar más estructuras tisulares que las hematoxilinas alumínicas, como las fibras de mielina y elastina. Uno de las más conocidas es la de Weigert, que se utiliza en la tinción Verhoff-Van Gieson, que se muestra en la imagen.
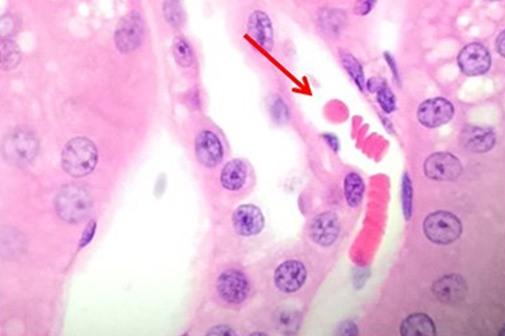
Una vez revisadas las tinciones nucleares, hablemos de los tintes del componente citoplásmico. La eosina es la contratinción más comúnmente utilizada que distingue entre el citoplasma y los núcleos de las células. Suele ser rosa, con diferentes tonos de rosa para diferentes tipos de fibras de tejido conjuntivo
La eosina Y es la forma de eosina más utilizada y puede utilizarse tanto en agua como en alcohol. La adición de una pequeña cantidad de ácido acético definirá aún más la tinción de la eosina. La eosina con floxina añadida realzará los rojos observados con la tinción con H&E. Por lo tanto, para aquellos que quieran ver rojos más intensos, se puede añadir floxina.
Muchos laboratorios consideran que pedir las tinciones es la forma más sencilla de garantizar una calidad uniforme y repetible. Una gran variedad de combinaciones de tinción de hematoxilina y eosina proporcionan la capacidad de personalizar los resultados deseados con muy poco esfuerzo. A medida que más técnicos se jubilan y las empresas se vuelven más eficientes, la reducción de personal hace que el uso de reactivos disponibles comercialmente sea ideal porque los técnicos pueden centrarse en la inclusión y el corte, que son las áreas del laboratorio que cuentan con la menor automatización.
A veces se utilizan otras mezclas de eosina, como EA50 y EA65. Estas tinciones se utilizan principalmente para citología y, además de la eosina Y, incluyen el verde claro, el amarillento y el marrón Bismarck. La adición de estos dos tintes proporciona las variaciones de color del citoplasma azul pálido al rosa, que se aprecia mejor en las células escamosas de una citología vaginal. La concentración de la mezcla determina la designación de 50 o 65.

La diferenciación de las tinciones permite eliminar de forma selectiva la tinción de los tejidos al gusto del técnico. En el caso de la hematoxilina, el ácido clorhídrico (para una diferenciación rápida) y el ácido acético (para una diferenciación más lenta y más controlada) se utilizan con mayor frecuencia. Aunque el ácido clorhídrico (HCl) ha sido históricamente el estándar, se utilizan ácidos más suaves para proporcionar una eliminación más suave del tinte. Parte de esta tendencia se debe al uso de la tinción automatizada, que debe adaptarse al movimiento del brazo robótico además del tiempo empleado en el reactivo.
Los reactivos que confieren coloración azul, como el agua corriente de Scott, se utilizan para cambiar la hematoxilina del rojo al color azul tradicional que esperamos. Estas soluciones ligeramente básicas alteran químicamente el colorante para producir este cambio de color. En algunos lugares, el agua del grifo contiene minerales en tales cantidades que el pH hace que el agua sea lo suficientemente básica como para permitir la tinción de color azul de los núcleos sin necesidad de un reactivo específico para el azulado. Sin embargo, en la mayoría de los casos, los laboratorios normalmente añaden este paso para garantizar un azulado adecuado.
En combinación, estos componentes constituyen la tinción estándar más utilizada en el laboratorio de histología.
Selección del protocolo de tinción H&E
El siguiente paso para obtener una buena tinción es determinar qué tipo de tinción H&E se desea. Por lo general, hay 3 tipos de tinciones H&E: progresivas, progresivas modificadas y regresivas.
La tinción progresiva se produce cuando la hematoxilina se añade al tejido sin ir seguida de un diferenciador para eliminar el exceso de colorante. Debido a que no hay un paso de diferenciación, puede producirse tinción de fondo, especialmente con preparaciones cargadas o tratadas. Los patólogos a veces prefieren este tipo de tinción, porque el material no celular, como la mucina, se tiñe con la hematoxilina. Esta tinción extracelular puede ser un indicador de tumores bien diferenciados.
Tabla: Este protocolo es una tinción simple regresiva que proporciona un buen equilibrio de tinciones nucleares y citoplasmáticas. Este protocolo está diseñado con un diferenciador de ácido suave en mente.
Una vez seleccionados los componentes de tinción, se recomienda comenzar con el protocolo inicial. A partir de ahí, se varía la hematoxilina en incrementos de 30 segundos o la eosina en incrementos de 15 segundos. Recuerde que la eosina tiende a penetrar mucho más rápido. A menos que sea necesario aclarar u oscurecer significativamente la intensidad de la tinción con eosina, los incrementos más cortos son los más convenientes. También es importante que solo se cambie una tinción cada vez. Puede parecer que la hematoxilina manifieste una tinción excesiva, cuando en realidad es la eosina la que debe ser más intensa.
A medida que los laboratorios siguen creciendo, es esencial la necesidad de resultados uniformes y un rendimiento continuo. La reproducibilidad es una parte importante de la calidad de las tinciones de laboratorio. Cuando se realiza la tinción manual, las variables humanas pueden hacer que cada rack de preparaciones teñidas tenga un aspecto diferente respecto al anterior. La automatización del proceso no solo elimina la posibilidad de introducir incoherencias, sino que también libera tiempo a los técnicos, el cual podrán dedicar a otras tareas del laboratorio.
Es importante lograr el equilibrio adecuado de los tintes. Una tinción excesiva con hematoxilina puede crear la ilusión de eosina insuficientemente teñida, al igual que la una tinción excesiva con eosina puede hacer que la hematoxilina parezca más clara de lo que realmente es. Por lo tanto, al optimizar la tinción, asegúrese de editar solo la hora de uno de los componentes. Esta técnica ayudará a eliminar la necesidad de dedicar tiempo adicional a ajustar la tinción.
| Xileno | 2 minutos |
| Xileno | 2 minutos |
| Etanol al 100% | 2 minutos |
| Etanol al 100% | 2 minutos |
| Etanol al 95% | 2 minutos |
| Lavado con agua | 2 minutos |
| Hematoxilina | 3 minutos |
| Lavado con agua | 1 minuto |
| Diferenciador (ácido suave) | 1 minuto |
| Lavado con agua | 1 minuto |
| Azulado | 1 minuto |
| Lavado con agua | 1 minuto |
| Etanol al 100% | 1 minuto |
| Eosina | 45 segundos |
| Etanol al 95% | 1 minuto |
| Etanol al 100% | 1 minuto |
| Etanol al 100% | 1 minuto |
| Xileno | 2 minutos |
| Xileno | 2 minutos |
| Cubreobjetos |
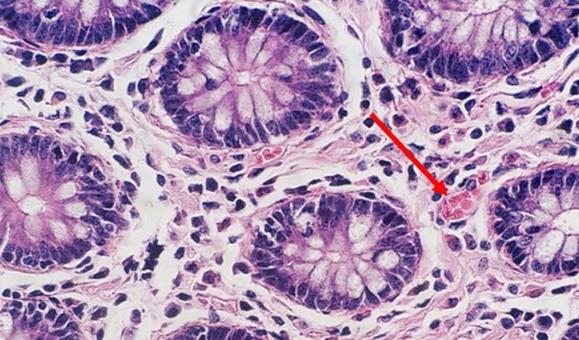
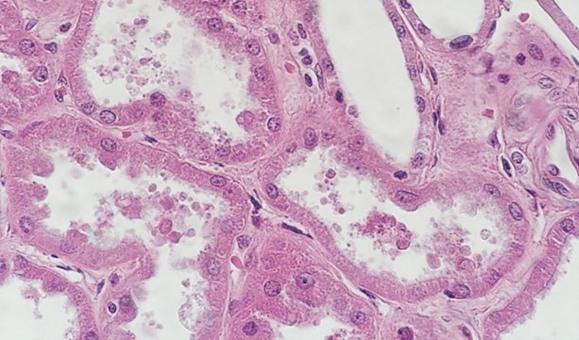
Con la tinción progresiva regresiva y modificada, se utiliza un diferenciador. Si el diferenciador se fabrica internamente, existe la posibilidad de que sea demasiado débil o demasiado fuerte. Ambos escenarios afectarán a la tinción. Si el diferenciador es más fuerte de lo previsto, eliminará más hematoxilina y hará que los núcleos se vuelvan más pálidos. El tiempo también es importante. El exceso de tiempo en un diferenciador adecuadamente preparado también eliminará más hematoxilina y acabará dando lugar a una tinción insuficiente de los núcleos.
Una acidez leve es fundamental para la vida útil de la hematoxilina. Sin ella, la alcalinidad del aclarado con agua del grifo elevará el pH, lo que hará que el lago de tinte pueda precipitarse y que el color cambie de rojo cereza a rojo púrpura. La adición periódica de pequeñas cantidades de ácido acético a la hematoxilina ayudará a mantener un pH adecuado y puede prolongar la vida útil de la tinción.
El agua se utiliza como diferenciador de la eosina. Es común seguir el paso de eosina con etanol al 95 %. El etanol ayuda a enjuagar la preparación, mientras que el agua extrae el exceso de eosina del tejido. Este paso puede ayudar con el control de la coloración, pero al extender el tiempo se obtienen tinciones más claras, mientras que acortándolo se mantiene una coloración más brillante. Sin embargo, el exceso de agua en xileno puede continuar el proceso de diferenciación y puede verse después del montaje como una opacidad rosa en la preparación.
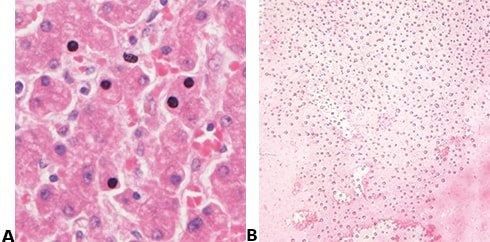
No todos los tejidos se crean de la misma forma. Los quistes y las muestras de grasa, incluso cuando se procesan correctamente, pueden ser muy difíciles de ver a simple vista una vez que se ha teñido la preparación. Estas muestras a menudo tienen espacios abiertos donde había líquidos o grasa en la célula, y la delgadez de las paredes celulares puede dar la apariencia de ser que son claras cuando la coloración es simplemente un artefacto del tipo de tejido.
Las muestras altamente celulares (p. ej., amígdala o ganglio linfático) pueden dar muchos problemas. Recuerde que los linfocitos tienen poco citoplasma y que no hay casi material celular entre las células como ocurre con otros tejidos. Por este motivo, la hematoxilina no tiene que competir con la eosina. La naturaleza compacta de las células también concentra el ADN, lo que proporciona a estos tejidos altamente celulares la apariencia de estar excesivamente teñidos, cuando en realidad, es posible que simplemente necesiten cortarse más finos.
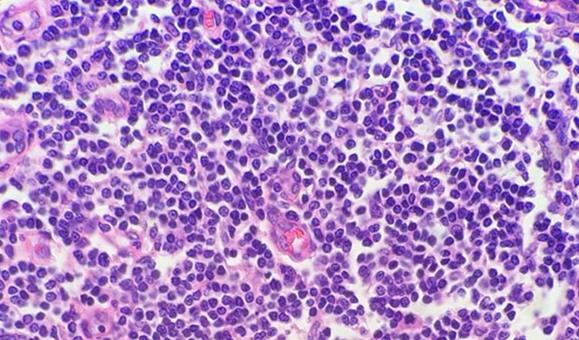
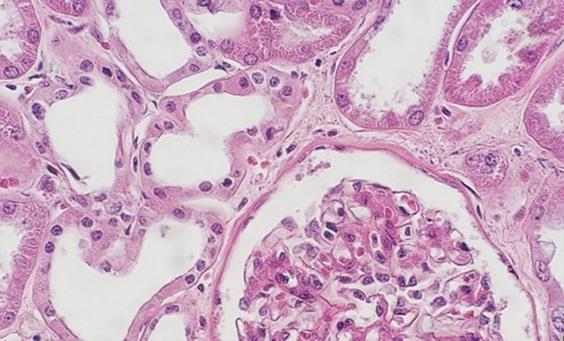
El uso de reactivos desparafinantes limpios y frescos es esencial para la eliminación de la parafina de la preparación antes de añadir los tintes. Aunque el xileno es el disolvente utilizado con más frecuencia, los sustitutos del xileno están ganando popularidad porque se consideran menos peligrosos y más ecológicos. La presencia de agua en los disolventes, ya sea proveniente de la contaminación de reactivos o de un entorno con alta humedad, reduce la capacidad del disolvente para eliminar la parafina. Los restos de parafina evitan que los tintes penetren en los tejidos, lo que da un aspecto desigual.
La forma más sencilla de evitar que esto ocurra es cambiar los reactivos con más frecuencia. La adición de una pequeña cantidad de gránulos de desecante (aproximadamente una cucharada por recipiente de reactivo) también reducirá la contaminación del agua en los disolventes. Estas medidas son especialmente importantes cuando se utiliza un sustituto del xileno, ya que estos reactivos tienden a ser mucho menos tolerantes a cualquier contaminación con agua en comparación con el xileno.
Guía paso a paso para realizar una tinción H&E
La tinción con hematoxilina y eosina (H&E) es la más utilizada en laboratorios de histología e histopatología. Cuando se realiza correctamente, tiene la capacidad de demostrar una amplia gama de componentes celulares y tisulares normales y anómalos, y es una tinción relativamente sencilla para realizar en secciones de parafina o congeladas. En histopatología, un patólogo experimentado puede diagnosticar una alta proporción de casos utilizando solo una tinción H&E.
Se puede teñir manualmente de forma efectiva un pequeño número de preparaciones en laboratorios con un alto rendimiento. Se puede realizar con éxito y de forma sistemática mediante estaciones de tinción de preparaciones automatizadas.
Hay una serie de diferentes formulaciones de hematoxilina y eosina de uso popular, cada una con varias ventajas y desventajas. Algunos laboratorios prefieren preparar sus propias soluciones, mientras que otros eligen productos comerciales listos para usar.
Introducción
La tinción H&E proporciona una imagen completa de la microanatomía de órganos y tejidos. La hematoxilina tiñe con precisión los componentes nucleares, incluidos la heterocromatina y los nucléolos, mientras que la eosina tiñe los componentes citoplasmáticos, como el colágeno y las fibras elásticas, las fibras musculares y los glóbulos rojos. En una H&E de alta calidad, existen diferencias sutiles en los tonos de color producidos por las tinciones, especialmente la eosina, y esto ayuda a la detección e interpretación de los cambios morfológicos asociados con la enfermedad.
Es importante que las personas que realizan y evalúan las tinciones H&E para verificar la calidad sean conscientes de las sutilezas de la tinción, conozcan lo que se puede lograr cuando la tinción se realiza correctamente con reactivos de alta calidad y sepan qué buscar microscópicamente. El mantenimiento de tinciones H&E uniformes y de alta calidad es un requisito fundamental en los laboratorios de histopatología.
En las secciones siguientes se describen los pasos básicos para realizar una tinción con H&E.
Retire la parafina
Tras la preparación de una sección de parafina, todos los elementos se infiltran y rodean con cera de parafina, que es hidrófoba e impermeable a los reactivos acuosos. La mayoría de los componentes celulares y tisulares no tienen color natural y no son visibles. El primer paso para realizar una tinción H&E es disolver toda la cera con xileno (un disolvente hidrocarbonado).
Hidratar la sección
Después de eliminar completamente la cera, se hace pasar la preparación por varios cambios de alcohol para eliminar el xileno y luego se enjuaga a fondo con agua. La sección ahora está hidratada para que los reactivos acuosos penetren fácilmente en las células y los elementos tisulares.
Aplicar la tinción nuclear de hematoxilina
La preparación ahora se tiñe con una tinción nuclear como la hematoxilina de Harris, que consiste en un colorante (hematoxilina oxidada o hemateína) y un mordiente o agente aglutinante (una sal de aluminio) en solución. Inicialmente, esto tiñe los núcleos y algunos otros elementos de color morado rojizo.
Complete la tinción nuclear mediante el “azulado”
Después de aclarar en agua del grifo, la sección se vuelve azul mediante el tratamiento con una solución débilmente alcalina. Este paso tiñe la hematoxilina de un color azul oscuro. Ahora se puede enjuagar y comprobar la sección para ver si los núcleos están correctamente teñidos y muestran el contraste adecuado y para evaluar el nivel de tinción de fondo.
Elimine el exceso de tinción de fondo (diferenciación)
En la mayoría de las ocasiones, cuando se emplea hematoxilina de Harris, se requiere un paso de diferenciación (destinción) para eliminar la tinción de fondo no específica y mejorar el contraste. Se utiliza un alcohol ácido débil. Después de este tratamiento, se requiere de nuevo el proceso de azulado y enjuagar a fondo. Los métodos de tinción que incluyen un paso de destinción o diferenciación se denominan tinciones “regresivas”.
Aplicar la contratinción con eosina
La sección se tiñe ahora con una solución acuosa o alcohólica de eosina (dependiendo de la preferencia personal). Esto tiñe muchos elementos no nucleares en diferentes tonos de rosa.
Enjuague, deshidrate, aclare y monte la preparación (aplicación del cubreobjetos)
Tras la tinción con eosina, la preparación pasa por varios cambios de alcohol para eliminar todos los restos de agua, y luego se aclara con varios baños de xileno, el cual “limpia” el tejido y lo hace completamente transparente. Se aplica una fina capa de medio de montaje de poliestireno, seguida de un cubreobjetos de vidrio. Si la tinción y todos los pasos posteriores se han realizado correctamente, la preparación revelará todos los componentes microscópicos importantes y permanecerá estable durante muchos años.
Resolución de problemas con tinciones con H&E
Aunque la tinción con H&E es relativamente sencilla de realizar, existen diversos artefactos que pueden interferir con una buena tinción.
Los artefactos pueden atribuirse a diversas causas.
Resolución de problemas con tinciones con H&E
Pasos para una mejor tinción de rutina (H&E) y colocación del cubreobjetos
Desde el paciente hasta el patólogo, la preparación de muestras de tejidos para su examen histológico requiere cuidado, habilidad y un procedimiento delicado. Esta guía proporciona asesoramiento práctico sobre las mejores técnicas, así como formas sencillas de evitar errores comunes.
En esta sección se proporcionan consejos para una mejor tinción rutinaria y la colocación del cubreobjetos. Esperamos que cada paso proporcione un valioso recordatorio de buenas prácticas histológicas y también ayude a solucionar problemas cuando se produzcan resultados inaceptables.
¿Desea ver los 101 pasos para una mejor histología?
Haga clic aquí para descargar su copia hoy mismo.
Paso 52: Usar un tiempo preciso
Cada paso del protocolo de tinción se cronometra con precisión.
Los tiempos de los pasos de la tinción son aproximados y, “si tenemos prisa”, se saltan algunos pasos. Esto puede producir resultados incoherentes.

Paso 53: Supervisar con regularidad la calidad
Se tiñen con regularidad preparaciones de control para supervisar la calidad de la tinción.
Nunca se utilizan preparaciones de control para tinciones con H&E. Esto puede dificultar mucho la determinación de si un problema de tinción se debe a reactivos de mala calidad, a un protocolo inadecuado o a una mala fijación.
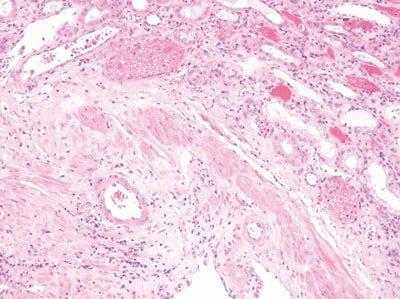
Paso 54: Estandarizar las condiciones de tinción
Los tiempos de agitación, lavado y drenaje se optimizan para todos los pasos durante la tinción.
Los tiempos de agitación, lavado y drenaje son incoherentes. Los disolventes y los reactivos se contaminan rápidamente. La tinción se vuelve incoherente.

Paso 55: Garantizar una eliminación completa de la parafina
Se optimiza la eliminación de parafina de las preparaciones.
La eliminación de parafina de las preparaciones a veces es incompleta y las preparaciones contienen parches de parafina residual. Esto produce zonas sin tinción o con tinción irregular en las secciones.
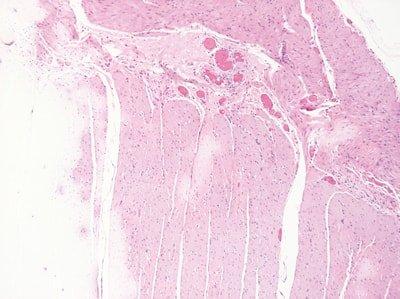
Paso 56: Renovar los reactivos con regularidad
Los disolventes y los reactivos de tinción se sustituyen regularidad en función del número de preparaciones teñidas o de racks procesados.
La sustitución de los disolventes y los reactivos de tinción es aleatorio. No se sustituyen hasta que la calidad de la tinción disminuye.
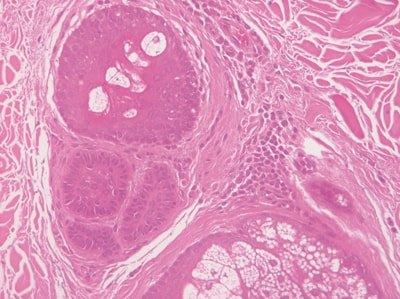
Paso 57: Hidratar las secciones a fondo
Las preparaciones se hidratan a fondo antes de la tinción con hematoxilina.
La solución de hematoxilina se contamina rápidamente con alcohol y a veces con xileno. Esto provoca una tinción irregular.
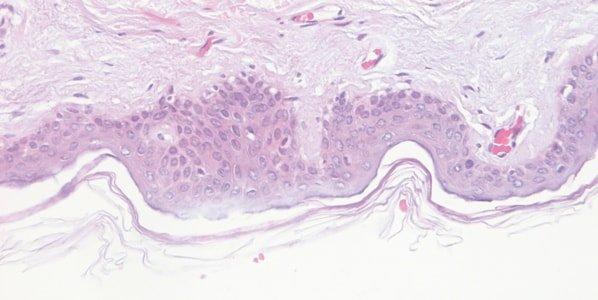
Paso 58: Supervisar la calidad de la hematoxilina
El rendimiento de las soluciones de hematoxilina se supervisa minuciosamente. Durante su vida útil, las soluciones de hematoxilina se diluyen progresivamente por el arrastre de preparaciones y racks y también se ven afectadas por la oxidación continua.
La tinción con hematoxilina es variable de un día a otro y no se intenta entender por qué. Por ejemplo, la zona de la superficie del baño de tinción, el grado de aireación durante la tinción y la temperatura ambiente pueden afectar a la velocidad de oxidación.
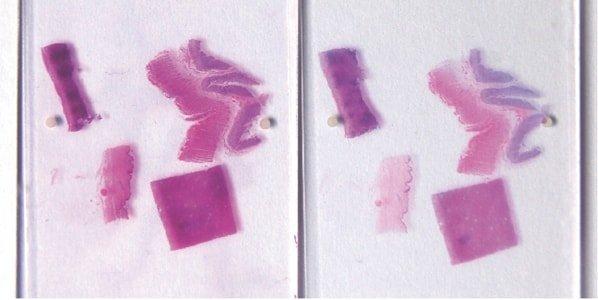
Paso 59: Garantizar el “azulado” nuclear completo
Después de la tinción con hematoxilina, siempre se realiza un “azulado” profundo de los núcleos con el sustituto de agua corriente alcalina de Scott o agua amoniacal. Este requisito se ve influido por el pH neutro del agua corriente local.
A veces, los núcleos aparecen rosáceos en secciones completadas debido al “azulado” incompleto en el agua corriente alcalina después de la tinción con hematoxilina. Los núcleos que están subteñidos con hematoxilina (o sobrediferenciados) y sobreteñidos con eosina también aparecen de color rosa.
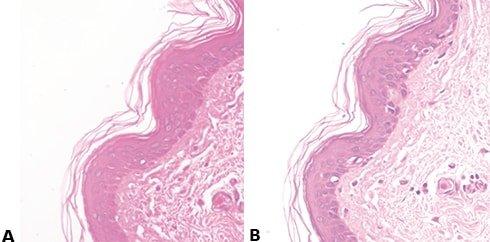
Paso 60: Evitar la tinción irregular con eosina
El “azulado” va seguido de un lavado muy a fondo con agua corriente para eliminar los álcalis residuales que pueden impedir la tinción con eosina y provocar una tinción débil e irregular.
El lavado ineficaz después del “azulado” (que deja álcalis residuales) hace que la tinción con eosina sea débil e irregular.
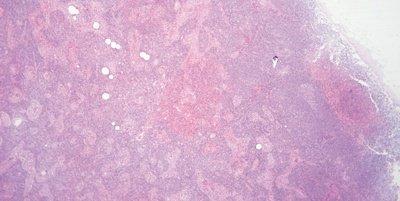
Paso 61: Supervisar el pH de la eosina
Se supervisa el pH de la solución de eosina. Se mantiene cerca de un pH de 5,0 para mantener una tinción óptima. Se puede añadir un par de gotas de ácido acético como medio cómodo para reducir el pH.
No se intenta supervisar el pH de la eosina. Cuando disminuye la intensidad de la tinción, se sustituye la solución (el arrastre de agua corriente alcalina puede hacer que el pH de las soluciones de eosina aumente).
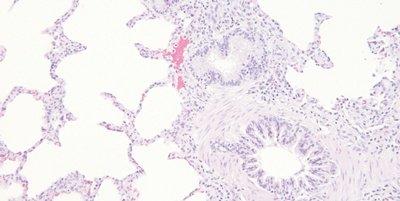
Paso 62: Deshidratar completamente antes del aclaramiento y del montaje
Las secciones se deshidratan completamente antes de colocarlas en xileno para su limpieza.
Las secciones a veces pasan rápidamente por alcohol hasta xileno. El aclaramiento con xileno contaminado con agua puede provocar la presencia de pequeñas gotas de agua en el tejido que se ven microscópicamente como zonas opacas sin detalles.
Paso 63: Evitar el secado y la formación de cristales
El cubreobjetos siempre se aplica antes de que la sección pueda secarse y se debe utilizar un material de montaje de alta calidad. Las propiedades de almacenamiento a largo plazo del medio de montaje deben conocerse porque pueden aparecer cristales en un material de montaje de baja calidad, a veces después de un largo periodo (meses o años).
Se permite que las secciones se sequen parcialmente antes de aplicar el cubreobjetos, lo que hace que algunos núcleos aparezcan negros. El medio de montaje elegido basándose únicamente en el precio puede desarrollar cristales durante el almacenamiento a largo plazo y los cubreobjetos pueden levantarse.
About the presenters

Cindy Sampias is a board certified Cyto- and Histo-technologist. With more than 25 years of experience, she is a guest speaker at histology and cytology meetings around the country. She is a technical author for Media Lab, publishing a variety of technical courses and sharing best practices in histology.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
Referencias
Leica Biosystems presenta este documento de referencia como un servicio para los profesionales sanitarios. Este ha sido preparado a partir de la literatura disponible. Aunque se ha hecho todo lo posible por mostrar la información de forma fiel, Leica Biosystems no se hace responsable de su exactitud. Este documento no pretende ser ni debe interpretarse como asesoramiento médico. Para cualquier uso, se deben consultar las guías de información del producto, los folletos y los manuales de funcionamiento de los distintos fármacos y dispositivos. Leica Biosystems y los editores renuncian a cualquier responsabilidad que surja directa o indirectamente del uso de cualquier fármaco, dispositivo, técnica o procedimiento descrito en este documento de referencia.
Related Content
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



