
Immunhistochemie: Eine Übersicht + Schritte zu einer besseren IHC-Färbung


Die Immunhistochemie (IHC) ist eine histologische Methode, mit der sich spezifische Proteinmarker nachweisen lassen, die wiederum in der Tumordiagnostik und -klassifizierung von Bedeutung sind. Dieser Leitfaden soll die grundlegenden Schritte veranschaulichen, die für eine IHC-Färbung nötig sind.
Eine Einführung in die Immunhistochemie
Die Immunhistochemie (IHC) ist eine histologische Methode, mit der sich spezifische Proteinmarker nachweisen lassen, die wiederum in der Tumordiagnostik und -klassifizierung von Bedeutung sind. Dieser Leitfaden soll die grundlegenden Schritte veranschaulichen, die für eine IHC-Färbung nötig sind.
Eine Einführung in die IHC-Färbung
Die Immunhistochemie (IHC) ist eine histologische Methode, mit der sich spezifische Proteinmarker nachweisen lassen, die wiederum in der Tumordiagnostik und -klassifizierung von Bedeutung sind. Die IHC hat sich ihren Platz in der Histologie als Ergänzung zur H&E-Färbung und den verschiedenen Spezialfärbungen gesichert. H&E- und Spezialfärbungen liefern wertvolle Informationen zur Gewebsmorphologie, aber sie bleiben unspezifisch. In der IHC hingegen geht es um die Darstellung einer genau definierten Zielstruktur, eines sogenannten Markers. Das macht die IHC zu einem wirkungsvollen Mittel in der Diagnostik solider Tumore und zytologischer Proben, wo sie seit fast einem halben Jahrhundert standardmäßig zum Einsatz kommt.
Zielantigen
Antigene sind Proteine, die sich innerhalb oder auf der Oberfläche einer Zelle befinden. Immer öfter stützen Pathologen ihre Diagnosen auf die An- oder Abwesenheit eines solchen Proteins.
Inzwischen kennen wir viele Hunderte von Antigenen, die von diagnostischem Nutzen sein können. In Untersuchungen schaut man deshalb oft auf eine ganze Reihe von Antigenen, die in ihrer spezifischen Kombination die Charakterisierung eines Tumors ermöglichen. Die Rede ist dann von einem Antigen-Panel.
Primärantikörper
Der erste Schritt zur IHC-Färbung besteht in der Anwendung eines Primärantikörpers, der selektiv an das Zielantigen bindet.
Dabei werden zwei Haupttypen von Antikörpern unterschieden: polyklonale und monoklonale. Beide Arten von Antikörpern binden spezifisch an definierte Epitope des Zielantigens. Bei polyklonalen Antikörpern handelt es sich um eine Mischung von Antikörpern, die an verschiedene Epitope des Zielantigens binden. Das macht sie anfälliger für Kreuzreaktionen zu anderen Antigenen.
Monoklonale Antikörper hingegen charakterisieren sich durch ihre Affinität zu einem einzigen Epitop des Zielantigens. Deshalb liefern sie in der Regel eine sauberere, spezifischere Färbung, die aber manchmal schwächer ausfällt als die, die mit polyklonalen Antikörpern erreicht werden kann.
Sekundärantikörper
Im zweiten Schritt werden Sekundärantikörper mit Affinität zum Primärantikörper eingesetzt. Diese Technik wird auch als indirekte IHC bezeichnet. Die indirekte IHC hat sich durchgesetzt, da die Möglichkeit besteht, durch Bindung mehrerer Sekundärantikörper an den Primärantikörper das Signal und damit die Färbung zu verstärken.
Das Detektionssystem
Das Detektionssystem baut auf den Sekundärantikörpern auf. Die moderne chromogene Detektion setzt auf Enzyme wie die Meerrettichperoxidase (Horseradish Peroxidase, HRP), die ihrerseits an einen Antikörper gekoppelt sind. Das Prinzip der Detektion weist ähnliche Merkmale auf wie die, die zuvor für die Sekundärantikörper beschrieben wurden: Ein Antikörper wird mit mehreren Enzymen konjugiert und dieses Konstrukt nennt sich Polymer. Polymere bewirken eine weitere Erhöhung der Signalstärke, da mehr Bindungsstellen für das Chromogen geschaffen werden.
Das Chromogen
Schließlich kommt ein Substrat zum Einsatz, das vom Enzym zu einem unlöslichen, farbigen Niederschlag umgesetzt wird, der unter dem Mikroskop visualisiert werden kann. Diaminobenzidin (DAB) und alkalische Phosphatase (AP) sind die beiden wichtigsten Chromogene. DAB präzipitiert braun, AP erzeugt roten Niederschlag.
DAB liefert eine kräftige, über die Zeit beständige Färbung und wird daher für die meisten Anwendungen bevorzugt. AP und andere rote Chromogene werden hauptsächlich für Hautschnitte verwendet, in denen braunes DAB durch gleichermaßen braunes Melaninpigment maskiert werden könnte.
Zuweilen werden DAB und AP auf denselben Schnitt angewandt, um zwei Antigene auf einmal visualisieren zu können. Dann ist die Rede von einer Doppelfärbung.
Eine vollständige IHC-Färbung
Das ist eine typische IHC-Färbung, bei der der braune Niederschlag die Präsenz des Zielantigens anzeigt – in diesem Fall Zytokeratin 5 in einer Prostatabiopsie. Die Stärke der Färbung, ihr Muster und ihre Lokalisation, z. B. in Relation zu Zellkern, Zytoplasma und Membranen, liefern allesamt wichtige Informationen für die Diagnosestellung.
Der blaue Hintergrund beruht auf einer Hämatoxylin-Gegenfärbung, wie sie oft nach dem Chromogen aufgetragen wird. Die Gegenfärbung dient der Darstellung der zugrunde liegenden Gewebestruktur und erhöht den Kontrast zwischen Chromogen und Präparat.
15 Schritte zu einer besseren IHC
Auf ihrem Weg vom Patienten zum Pathologen erfordert die Vorbereitung einer Gewebeprobe für die histologische Untersuchung Sorgfalt, Geschick und verlässliche Verfahren. Dieser Leitfaden gibt praktische Ratschläge zu bewährten Methoden und erklärt, wie häufige Fehler vermieden werden können.
In diesem Artikel liegt der Fokus auf Tipps für eine bessere IHC. Wir hoffen, dass die einzelnen Schritte helfen, die gute histologische Praxis in Erinnerung zu rufen, und dass sie die Fehlersuche vereinfachen, wenn die Ergebnisse mal nicht zufriedenstellend sein sollten.
Möchten Sie alle 101 Schritte zu einer besseren Histologie sehen?
Klicken Sie hier, um unsere 101 Schritte zu einer besseren Histologie jetzt herunterzuladen!
Schritt 1 - Hochwertige Schnitte verwenden
Es werden ausschließlich dünne, flache Schnitte verwendet, die gründlich getrocknet wurden. In der Immunhistochemie kommen vorzugsweise geladene oder mit 3-Aminopropyltriethoxysilan (APES) beschichtete Objektträger zum Einsatz.
Unebene, schlecht haftende Schnitte färben ungleichmäßig mit variabler Hintergrundfärbung.
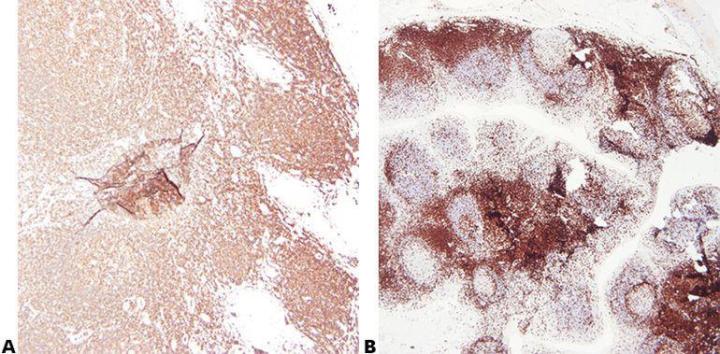
Schritt 2 - Optimale Fixierung sicherstellen
Eine gute Fixierung unter bekannten und gleichbleibenden Bedingungen bezüglich Fixiermittel, pH-Wert, Temperatur und Zeit liefert die besten Ergebnisse. Die Proben werden vor der Infiltration überprüft, um festzustellen, ob eine zusätzliche Fixierung erforderlich ist.
Variable Fixierungsbedingungen, die zur Unter- oder Überfixierung des Gewebes führen, sind keine gute Basis für reproduzierbare Ergebnisse. Außerdem erschweren sie die Fehlersuche.

Schritt 3 - Unzureichender Schnitthaftung vorbeugen
Im Wasserbad wird die Verwendung von Kleber auf Proteinbasis, z. B. Stärke- oder Gelatinekleber, vermieden. Das gilt insbesondere, wenn die Schnitte auf geladene Objektträger aufgezogen werden.
Kleber auf Proteinbasis können die Oberfläche des geladenen Objektträgers blockieren. So haften die Schnitte schlechter und heben sich stellenweise ab. An eben diesen Stellen sammeln sich die Reagenzien und provozieren Unregelmäßigkeiten im Färbeergebnis.

Schritt 4 - Konzentrationsgefälle vermeiden
Konzentrationsgefälle werden durch sorgfältiges Auftragen der Reagenzien vermieden.
Konzentrationsgefälle resultieren im Farbverlauf über den Objektträger, d. h. ein Ende ist stark gefärbt und zum anderen Ende hin nimmt die Färbeintensität ab.
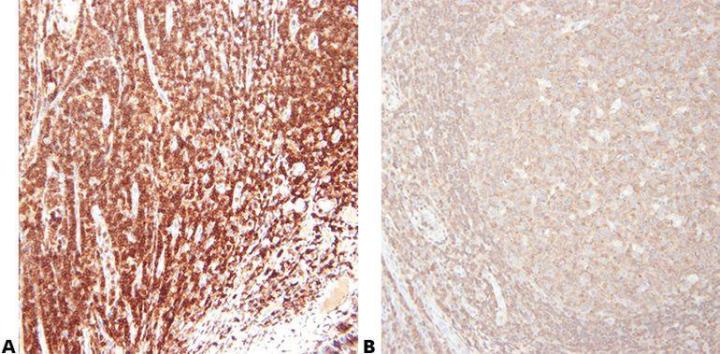
Schritt 5 - Antikörper sorgfältig auswählen
Die primären Antikörper werden sorgfältig und unter Berücksichtigung ihrer Sensitivität und Spezifität ausgewählt. Antikörper, die von verschiedenen Anbietern verkauft werden, stammen oft aus der gleichen Quelle und werden für den Vertrieb lediglich neu etikettiert und verpackt. Wenn es um Informationen zu einem spezifischen Antikörper geht, ist deshalb der Name des Klons zu verwenden.
Antikörper werden allein aufgrund des Preises gekauft.

Schritt 6 - Datenblätter lesen
Sie kennen Ihre primären Antikörper. Aus dem zugehörigen Datenblatt geht hervor, ob der jeweilige Antikörper mit der gewählten Methode kompatibel ist. Es lohnt sich, die gesammelten Datenblätter zu aktualisieren, wenn eine neue Charge von Antikörpern gekauft wird.
Die Mitarbeiter des Labors haben keinen Zugriff auf die Datenblätter zu den Antikörpern, die sie verwenden.
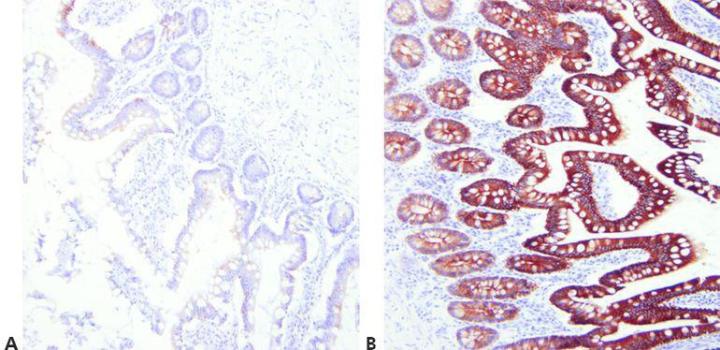
Schritt 7 - Geeignete Methoden zur Demaskierung wählen
Die Wahl der Methode zur Demaskierung erfolgt in Abhängigkeit vom Primärantikörper, dem zu färbenden Gewebe und der Fixierung (pH-Wert, Reagens, Reaktionsbedingungen).
Unter der Annahme, dass es ein erfolgreiches universelles Verfahren zur hitzeinduzierten Antigen-Demaskierung gäbe, wird für alle Primärantikörper die gleiche Demaskierungstechnik gewählt.
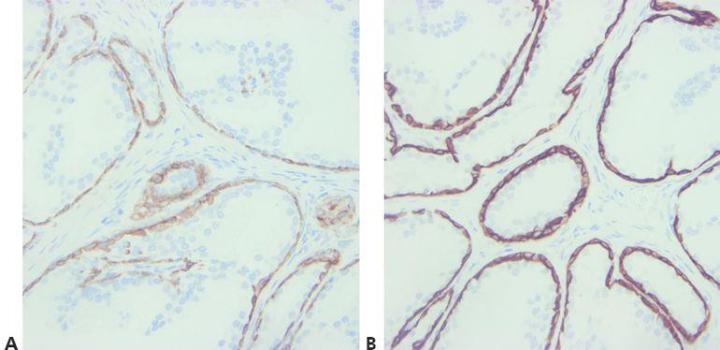
Schritt 8 - Kreuzreaktivität der Antikörper berücksichtigen
Eine mögliche Kreuzreaktivität der verwendeten Antikörper findet Berücksichtigung. Bei Zweifeln wird das zugehörige Datenblatt konsultiert.
Man versucht gar nicht erst, unerwartete positive Färbungen zu erklären.
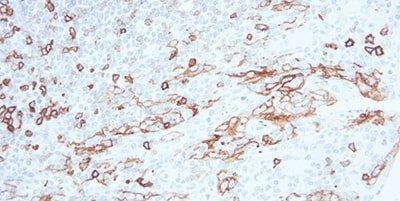
Schritt 9 - Endogene Peroxidase blockieren
Um zuverlässige Ergebnisse aus Peroxidase-basierten Detektionssystemen zu erhalten, wird zunächst die endogene Peroxidase blockiert.
Erythrozyten, Granulozyten, Monozyten und Muskelgewebe färben sich zum Teil unspezifisch an, wenn die Aktivität der endogenen Peroxidase nicht vollständig blockiert wird.
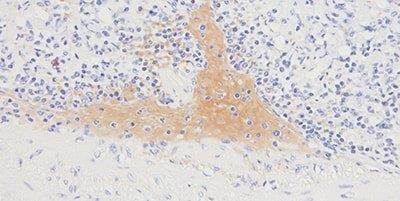
Schritt 10 - Hintergrundfärbung reduzieren
Zur Vermeidung einer unspezifischen Hintergrundfärbung wird Wert auf eine effektive Proteinblockierung gelegt.
In den Präparaten besteht eine generalisierte Hintergrundfärbung, die sich in einem ineffektiven Proteinblock begründet.

Schritt 11 - Geeignetes Detektionssystem verwenden
Es wird ein Detektionssystem gewählt, das ausreichend sensibel und spezifisch ist, um eine präzise Färbung zu erreichen.
Es wird stets dasselbe Detektionssystem genutzt. Man ist darauf eingespielt und sieht keinen Bedarf, Änderungen vorzunehmen. Dabei wird in Kauf genommen, dass Färbungen manchmal schwach und unklar sind.
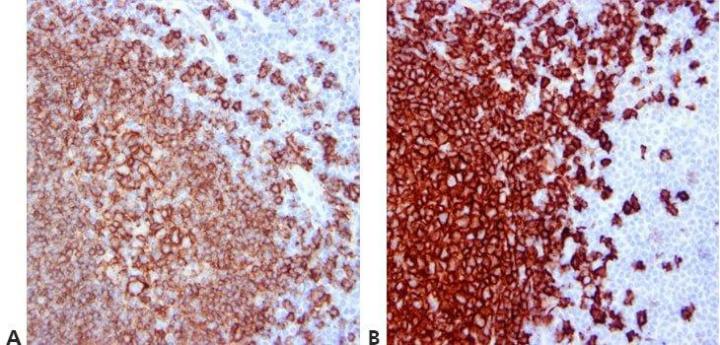
Schritt 12 - Waschschritte standardisieren
Sämtliche Waschschritte sind bezüglich Dauer, Volumen und Schütteln standardisiert. Damit wird ein wesentlicher Beitrag zur Reproduzierbarkeit der Ergebnisse geleistet.
Bei Verwendung desselben Antikörpers werden in verschiedenen Durchläufen unterschiedliche Ergebnisse erzielt. Dafür können Variationen in der von einzelnen Mitarbeitern angewandten Waschtechnik verantwortlich sein.
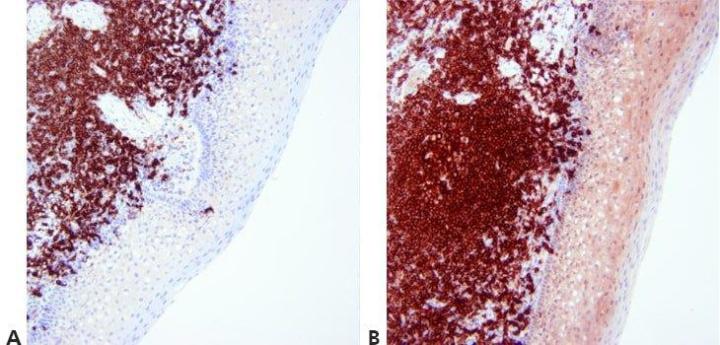
Schritt 13 - Gegenfärbung optimieren
Die Intensität der Kerngegenfärbung wird sorgfältig reguliert und standardisiert, um positive Färbeergebnisse nicht zu überdecken. Die Gegenfärbung wird so eingesetzt, dass der Kontrast zwischen Chromogen und Hintergrundgewebeelementen maximiert wird. Deshalb erfolgt die Wahl der Gegenfärbung in Abhängigkeit vom Chromogen.
Die Gegenfärbung der Zellkerne ist zu stark. Damit besteht das Risiko, schwache spezifische Färbungen zu übersehen.
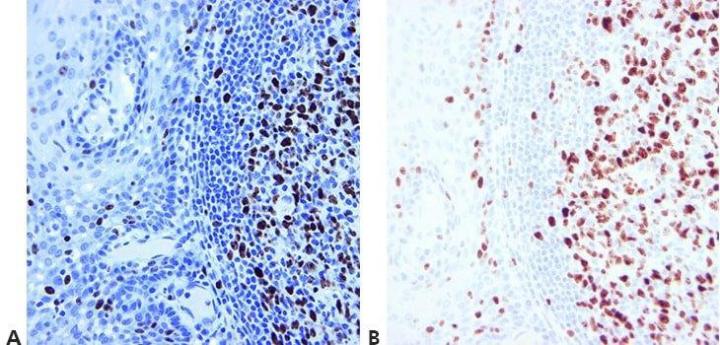
Schritt 14 - Geeignete Kontrollen mitführen
Es werden immer geeignete Positiv- und Negativkontrollen mitgeführt, die zur Validierung der Ergebnisse dienen. Interne Positiv- und Negativkontrollen sind ihrerseits von Bedeutung; sie stellen ein hervorragendes Mittel zur Qualitätssicherung in der Immunhistochemie dar.
Kontrollen werden durchgeführt, wenn die Methode nicht zu funktionieren scheint. Darüber hinaus werden sie als überflüssig angesehen oder vielleicht sogar mitgeführt, aber nicht angeschaut.
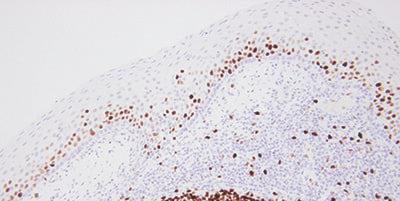
Schritt 15 - Ergebnisse sorgfältig auswerten
Sie wissen, wonach Sie suchen und wo Sie hinschauen müssen, um Ihre Schnitte der Fragestellung nach zu beurteilen.
Man geht davon aus, dass eine Färbung funktioniert hat, wenn ein Objektträger Farbe zeigt.
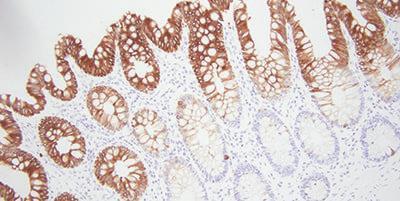
Bonustipp: Die Wahl der richtigen Antikörper
Ein wichtiger Schritt, dem nicht immer die notwendige Aufmerksamkeit zuteilwird, ist die Auswahl von Antikörpern, die für die IHC geeignet sind. Wenn Sie hier ein bisschen mehr Zeit investieren, kann Ihnen das später viele Kopfschmerzen ersparen. Suchen Sie in der Literatur nach spezifischen Antikörpern, fragen Sie bei den Anbietern nach und auch bei Ihren Kollegen.
Es gibt mehrere Dinge, die in Bezug auf Antikörper zu beachten sind. Was in einem anderen Labor gut funktioniert, bedarf in Ihrem vielleicht einer Anpassung. Jeder von Ihnen eingesetzte Antikörper muss in Ihrem Färbesystem getestet werden. Im Laufe der Zeit können Antikörper zudem ihre Färbeintensität verlieren. Das gilt insbesondere, wenn sie Licht und Luft ausgesetzt sind.
Konzentrat vs. RTU-Antikörper
Wer Antikörper auswählt, muss zunächst eine grundsätzliche Entscheidung treffen: Wird ein Konzentrat bevorzugt oder ein vorverdünntes, gebrauchsfertiges Ready-to-use-Format (RTU)? Konzentrate sind flexibler in der Anwendung, sind preiswerter und können in der Regel in jedem Färbesystem eingesetzt werden, einschließlich manueller Techniken und Färbeautomaten, solange der Hersteller nichts anderes empfiehlt. Konzentrate können so verdünnt werden, dass ein optimales Gleichgewicht zwischen Kosten, Färbezeit und Qualität erreicht wird. Andererseits kann die Verdünnung je nach Protokoll und Erfahrungswerten variiert werden. Damit sind Konzentrate der ideale Ausgangspunkt für Anpassungen der Methodik und den Einsatz in mehreren Protokollen, die verschiedene Konzentrationen erfordern. Aber diese Flexibilität kostet Zeit und sämtliche Verdünnungen müssen für ihren jeweiligen Einsatz validiert werden. Da es keine universelle Methode gibt, die Eigenschaften und Stabilität eines verdünnten Antikörpers zu bestimmen, ohne dafür umfangreiche Studien anzustellen, kann sich außerdem die Färbung beeinträchtigt sehen, wenn ein allmählicher Qualitätsverlust nicht bemerkt wird. Dieses Problem besteht bei den RTU-Antikörpern nicht. Zu ihren Vorteilen zählt neben einer besseren Qualitätskontrolle und einem einfacheren Reagenzienmanagement auch die erhöhte Effizienz beim Arbeiten. Man spart sich die Zeit, um Verdünnungen herzustellen und diese für die jeweiligen Protokolle zu validieren. Bei geringerer Variation von Durchlauf zu Durchlauf wird die Reproduzierbarkeit erhöht, insbesondere wenn die Proben in Färbeautomaten mit assoziierten Detektionssystemen verarbeitet werden. Mit einer definierten Anzahl von Testläufen und einem vom Hersteller verifizierten Verfallsdatum vereinfachen die RTUs das Antikörpermanagement. Darüber hinaus können RTUs zum Ausbau der Laborleistungen beitragen, weil die Verwendung neuer Antikörper nicht länger an personal- und zeitaufwendige Validierungen gebunden ist.
Bonustipp: Die Bedeutung der Standardisierung vor der Färbung
Jeder Pathologe, Laborleiter und Histotechnologe weiß, dass eine gute IHC-Färbung in dem Moment auf den Weg gebracht wird, in dem die Probe genommen wird. In der Literatur sind die optimalen Bedingungen für Fixierung, Infiltration und Schnitterstellung ausreichend dokumentiert. Sie zielen auf ein präzises morphologisches Bild und die Erhaltung der Antigenität der Gewebebestandteile ab und sollten kontinuierlich überprüft und gegebenenfalls verbessert werden, um die Zuverlässigkeit und Reproduzierbarkeit der Ergebnisse sicherzustellen. Das könnte bedeuten, dass in dem Bewusstsein um die Bedeutung der ersten Schritte in der Probenverarbeitung am Ort der Probenahme ein Labor aufgebaut wird.
Die notwendige Infrastruktur, etwa eine automatisierte Probenannahme, das LIS und ein System zur Rückverfolgbarkeit ist über das Labor hinaus anzulegen und sollte definitiv bis an den Ort der Probenahme reichen. Das schließt eine standardisierte Vorbereitung derselben ein, beispielsweise die Verfügbarkeit von Gefäßen und Fixiermitteln. Vergleichen lässt sich das mit der Arbeit im Blutanalyselabor, das Blutproben auch nicht in beliebigen Gefäßen empfängt, sondern in standardisierten, beschichteten Entnahmeröhrchen, die mit Barcodes versehen sind, die jederzeit eine zweifelsfreie Identifikation von Probe und Patient ermöglichen.
Die Verknüpfung von Fixierung, Gewebeverarbeitung und IHC-Färbung schafft einen Mehrwert für die Qualitätskontrolle. Labore, die die Bedingungen überwachen, unter denen die der Färbung vorgelagerten Verarbeitungsschritte stattfinden, und diese mit ihren Aufzeichnungen zu IHC-Färbungen in Verbindung setzen, schaffen eine strenger qualitätskontrollierte Umgebung für die Diagnosestellung. Außerdem empfiehlt es sich, die Variabilität der Bedingungen, unter denen diese frühen Schritte erfolgen, regelmäßig zu kontrollieren. Eine Kontrolle je 100 Objektträger mag dabei als Richtwert gelten; gleichzeitig erleichtern solche Kontrollen die Bewertung von Leistung und Toleranzbereich des Färbesystems. Diese Arbeitsabläufe und Technologien werden sich in dem Maße weiterentwickeln, wie die IHC ausreift. Aber auch heute schon können wir auf eine Reihe bewährter Praktiken zurückgreifen, von denen wir wissen, dass sie zu Qualität und Konsistenz in der IHC-Färbung beitragen (siehe nachfolgende Tabelle).
| Arbeitsschritt | Ort | Häufige Probleme mit Auswirkungen auf die IHC |
|---|---|---|
|
Exzision/Biopsie |
Chirurgische Abteilung/Arztpraxis |
|
|
Probenannahme |
Labor |
|
|
Grober Zuschnitt |
Labor |
|
|
Probenverarbeitung |
Labor |
|
|
Einbettung |
Labor |
|
|
Mikrotomie |
Labor |
|
|
Aufschwimmen |
Labor |
|
Laden Sie Ihr Exemplar unserer 101 Schritte zu einer besseren Histologie herunter!
About the presenters

James Anderson is a Global Marketing Manager at Leica Biosystems with experience with histology and scientific, technical, and marketing communications.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.

Steven Westra is a renowned antibody staining consultant with over ten years of experience in the immunohistochemistry industry.
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2025 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.