
H&E 염색 개요: 모범 사례 가이드


일반 진단에서 헤마톡실린과 에오신(H&E)을 사용하면 병리학자들이 세포와 조직 구조를 자세하게 확인할 수 있습니다. 병리학자의 실습 경험과 개인적 선호도에 따라 염색 강도 요구가 변하는 경우가 많습니다. 이 염색에서는 다양한 세포질, 핵 및 세포 외 기질 특성을 보여주므로 거의 모든 학습 교재에서 H&E 이미지를 사용합니다. 이는 한 세기 이상 동안 변함없이 사용되고 있는 필수 염색입니다.
H&E 염색 절차는 기본 프로토콜을 따릅니다.
- 왁스제거
- 탈수
- 헤마톡실린
- 분별
- 청색화
- 에오신
- 탈수
- 투명화
- 봉입
시약은 손쉽게 재현되며 시약 복원성은 시약을 교환해야 하기 전에 슬라이드 여러 개를 일관되게 염색할 수 있을 정도로 충분해야 합니다.
이전에는 일상적으로 실험실에서 염색제와 해당 성분을 만들었습니다. 시중에서 판매하는 미리 제조된 시약은 흔하지 않았고 값도 비쌌습니다. 따라서 H&E를 경제적으로 수행하는 방법으로 염료를 필요한 만큼 제조하는 기술을 학습했습니다. 문제는 염색 품질을 일관되게 유지하는 것이 어렵다는 점이었습니다. 기술마다 각자 고유한 방식을 사용한 레시피를 따랐으므로 일반적으로 사람마다 다르게 염료를 제조했습니다. 즉, 실험실에 여러 가지 기술이 있었고 이로 인해 시약을 준비하는 데 걸리는 시간이 팀 전체 작업에서 큰 비중을 차지했습니다.
많은 실험실에서 일관되고 반복 가능한 품질을 보장하면서 가장 간단하게 염색할 수 있는 방법을 찾습니다. 헤마톡실린과 에오신 염색을 다양한 방식으로 조합하여 활용할 수 있으므로 간단하게 원하는 결과를 맞춤 설정할 수 있습니다. 많은 기술이 사장되고, 운영 규모가 작아지고, 인력이 줄어듦에 따라 시중에서 판매하는 시약을 사용하는 것이 좋습니다. 기술을 통해 포매 및 박절에 집중할 수 있고, 이 기술은 최소한의 자동화를 제공하는 실험실 영역이기 때문입니다.
조직학 분야에 새롭게 입문하는 전문가에게 있어 시약 제조는 빠르게 퇴색되고 있습니다. 저는 이러한 변화가 문제가 될 것으로 보고 있습니다. 주된 이유는 특징적으로 이러한 변화에서 조직학의 특징적 기예가 사라지기 때문입니다. 학생들과 작업할 때 어려움 중 하나는 염색 문제를 해결하기 위해 그들을 도와줘야 한다는 점입니다. 염색제를 실험실에서 제조하면 팀은 경험을 통해 성분이 손실되거나 혼합물에 잘못 첨가되면 어떤 현상이 발생하는지 학습합니다. 이러한 변화는 염색된 슬라이드에서 미묘한 변화를 만들므로 궁극적으로 조직학 팀은 이러한 변화를 해결하려고 합니다. 결국 새로운 조직학 팀은 시약 제조 경험과 이 과정에서 학습한 교훈이 없으므로 쉽게 해결할 수 있는 미묘한 변화 문제를 해결할 때 곤란함을 겪을 수 있습니다.
H&E 염색이란?
헤마톡실린과 에오신 염색은 동결 절편, 세침흡인 및 파라핀 고정 포매된 조직을 포함한 다양한 조직학 실험 영역에서 사용되고 있습니다. 염색이 잘 된 슬라이드를 만드는 방법을 이해하려면 염색 성분을 이해해야 합니다.
헤마톡실린은 세포 내 핵을 상세하게 보여주기 위해 사용됩니다. 착색 깊이는 핵 내 DNA 양과 관련이 없을뿐더러 시료가 헤마톡실린에 있는 시간과도 관련이 없습니다.
헤마톡실린은 제조하기 쉬운 간단한 염료입니다. 염료 자체는 캄파치 나무에서 추출됩니다. 헤마톡실린이 산화되면 헤마테인이 생성되며 헤마테인이 H&E 염색에 사용되는 실제 염료입니다. 매염제를 첨가하면 헤마테인이 조직의 음이온(음 전하를 띠는) 성분에 부착되는 성능이 향상됩니다.
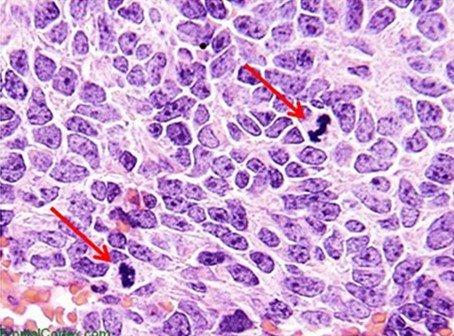
헤마톡실린은 일반적으로 염색 전에 사용된 매염제별로 분류됩니다. 매염제는 헤마틴의 양이온 전하를 강화합니다. 이를 통해 대부분 염색질인 음이온 조직 성분과 헤마틴이 결합합니다. 또한 매염제 유형은 염색된 성분의 최종 색상에 영향을 미칩니다. 일반 조직학에서 가장 많이 사용되는 매염제는 황산 알루미늄 암모늄(백반)입니다. 이 매염제로 인해 핵이 빨간색으로 염색되고 나중에 시료를 약한 기본 용액으로 헹구면 보다 익숙한 파란색으로 변경됩니다.
Mayer의 헤마톡실린은 염색에 가장 많이 사용되는 백반 헤마톡실린이며 진행성 염색과 퇴행성 염색 모두에 사용할 수 있습니다. 특수 염색과 면역조직화학의 핵 대조 염색으로 사용되는 경우가 많습니다. 이러한 응용 분야에서는 Mayer를 사용하여 핵을 염색한 후 분별제를 사용하지 않고 청색화합니다. Mayer는 수용성 염색제입니다.
Harris 헤마톡실린은 널리 사용되는 또 다른 백반 헤마톡실린으로, 세포학 시료의 진행성 염색에 사용될 수 있습니다. 하지만 조직학에서는 진행성 염색이나 퇴행성 염색에 사용될 수도 있습니다. 염색은 핵 세부 사항을 명확하게 보여줍니다. Harris를 사용할 때의 한 가지 문제점은 널리 사용되는 염산 기반 분별제와 달리 약산에서 최고로 분된다는 점입니다. Harris는 알코올 기반 염색제입니다. Gill 헤마톡실린은 백반 헤마톡실린입니다. 진행성 염색이나 퇴행성 염색에 사용되며 다양한 농도로 제공됩니다. 물과 에틸렌 글리콜로 제조되므로 일반적으로 염색제가 수 개월 이상 자연적으로 산화되지 않아 Harris 헤마톡실린보다 안정적입니다. 하지만 Gill의 특성으로 인해 핵 외 다른 성분이 염색될 수 있습니다. 슬라이드에 사용되는 뮤신과 점착제는 Gill에 의해 심하게 오염될 수 있습니다.
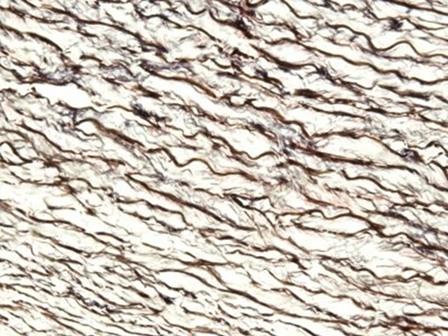
매염제로 철염을 사용하는 헤마톡실린은 일반적으로 특수 염색에 사용됩니다. 이러한 헤마톡실린이 백반 헤마톡실린에 비해 수초(myelin) 및 탄력 섬유 등과 같은 조직 구조물을 잘 보여줄 수 있기 때문입니다. 가장 유명한 헤마톡실린은 Weigert로, 그림과 같이 Verhoff-Van Gieson 염색에 사용됩니다.
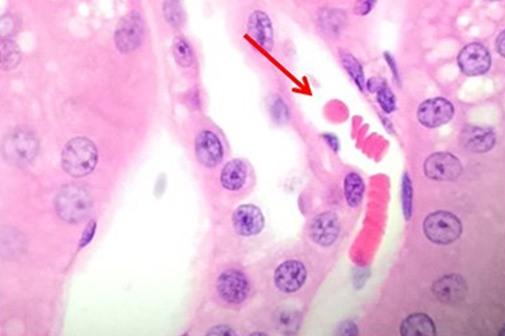
핵 염색에 대해 알아보았습니다. 지금부터는 세포질 염료를 살펴보겠습니다. 에오신은 가장 일반적으로 사용되는 대조 염색으로, 세포의 세포질과 핵을 구분합니다. 일반적으로 분홍색이며 결합 조직 섬유 유형마다 분홍색 음영이 다릅니다.
에오신 Y는 가장 일반적으로 사용되는 에오신 형태이며 물과 알코올 모두에서 사용될 수 있습니다. 아세트산을 소량 첨가하면 에오신 염색이 선명해집니다. 에오신에 플록신(phloxine)을 첨가하면 H&E 염색에서 보이는 빨간색이 더욱 선명해집니다. 따라서 빨간색을 더욱 선명하게 보고 싶으면 플록신을 첨가하면 됩니다.
많은 실험실에서 일관되고 반복 가능한 품질을 보장하기 위해 가장 간단하게 염색할 수 있는 방법을 찾습니다. 헤마톡실린과 에오신 염색을 다양한 방식으로 조합하여 활용할 수 있으므로 간단하게 원하는 결과를 맞춤 설정할 수 있습니다. 많은 기술이 사장되고, 운영 규모가 작아지고, 인력이 줄어듦에 따라 시중에서 판매하는 시약을 사용하는 것이 좋습니다. 기술을 통해 포매 및 박절에 집중할 수 있기 때문입니다. 이 기술은 최소한의 자동화를 제공하는 실험실 영역입니다.
EA50 및 EA65와 같은 다른 에오신 혼합물이 사용되는 경우도 있습니다. 에오신 Y 외에 이러한 염색제는 주로 세포학에 사용되고 색상에는 연두색, 노란색 및 비스마르크 브라운 등이 있습니다. 이러한 두 염료를 첨가하면 세포질의 색상이 연한 파란색에서 분홍색까지 다양해지므로 이를 사용하면 자궁 경부 세포진 검사에서 편평 세포를 가장 잘 확인할 수 있습니다. 혼합 농도는 50 또는 65 중에서 결정됩니다.

염색제를 분별하면 보는 사람에 따라 조직에서 염색을 선별적으로 제거할 수 있습니다. 헤마톡실린의 경우 염산(고속 분화용)과 아세트산(느리고 더욱 통제된 분별용)이 가장 널리 사용됩니다. 전통적으로 염산(HCl)이 표준이었지만 보다 약한 산을 사용하면 원활하게 염료를 제거할 수 있습니다. 이러한 경향 중 일부는 시약에 머무르는 시간이 긴 로봇 암으로 이동해야 하는 자동 염색을 사용함으로써 발생했습니다.
Scott's Tap Water와 같은 청색화 시약을 사용하면 헤마톡실린이 빨간색에서 우리가 원하는 전통적인 파란색으로 변합니다. 이러한 다소 기초적인 용액은 화학적으로 염료를 변경하여 이러한 색상 변화를 유발합니다. 일부 위치의 수돗물에는 미네랄이 풍부하여 pH로 인해 특정 청색화 시약을 사용하지 않고도 핵을 청색화할 수 있습니다. 대부분의 사례에서 실험실은 적절한 청색화를 보장하기 위해 이 단계를 추가합니다.
이러한 성분을 결합하면 조직학 실험실에서 가장 많이 사용되는 표준 염색제가 생성됩니다.
H&E 염색 프로토콜 선택
우수한 염색제를 만든 후에는 사용할 H&E 염색 유형을 결정합니다. 일반적으로 H&E 염색 유형에는 진행성, 변형 진행성(modified progressive) 및 퇴행성 등 3가지가 있습니다.
조직에 헤마톡실린을 첨가한 후 분별제를 첨가하지 않고 초과 염료를 제거하면 진행성 염색입니다. 분화 단계가 없으므로 백그라운드 염색이 특히 전하를 띠거나 처리된 슬라이드에서 발생할 수 있습니다. 뮤신과 같은 세포가 아닌 물질이 헤마톡실린으로 염색되므로 병리학자들이 이 유형의 염색을 사용하는 경우가 있습니다. 이 세포 외 염색을 사용하면 잘 분별된 종양을 확인할 수 있습니다.
표: 이 프로토콜은 균형 잡힌 핵과 세포질 염색을 제공하는 단순한 퇴행성 염색입니다.
염색 성분을 선택하면 기준선 프로토콜로 시작할 수 있습니다. 거기서부터 30초 간격으로 헤마톡실린을 또는 15초 간격으로 에오신을 조정합니다. 에오신이 보다 빠르게 침투합니다. 에오신 염색 강도를 심하게 밝거나 어둡게 할 필요가 없으면 간격을 줄이는 것이 좋습니다. 또한 염색을 한 번에 하나만 변경해야 합니다. 에오신만 더 많이 필요한 경우에는 헤마톡실린이 과다 염색될 수 있습니다.
실험실이 성장함에 따라 일관된 결과와 지속적인 처리량이 중요합니다. 재현성은 실험실 염색 품질의 중요한 요소 중 하나입니다. 사람이 직접 염색하면 염색된 각 슬라이드 랙이 마지막 슬라이드와 다르게 보일 수 있습니다. 자동화하면 불일치 가능성이 제거될 뿐만 아니라 숙련된 기술자가 없어도 가능하고, 다른 작업을 수행할 수 있습니다.
염료를 올바르게 균형 잡는 것이 중요합니다. 헤마톡실린이 과다 염색되면 염색된 에오신을 잘못 이해할 수 있고 에오신이 과다 염색되면 헤마톡실린이 실제보다 밝게 보일 수 있습니다. 따라서 염색을 최적화하는 경우에는 한 번에 성분 하나만 조정해야 합니다. 이 기법을 사용하면 염색을 조정하는 데 걸리는 불필요한 시간을 없앨 수 있습니다.
| 자원렌 | 2 분 |
| 자원렌 | 2 분 |
| 100% 에탄을 | 2 분 |
| 100% 에탄을 | 2 분 |
| 95% 에탄을 | 2 분 |
| 물로 세적 | 2 분 |
| 헤마톡실린과 | 3 분 |
| 물로 세적 | 1 분 |
| 분별제(약산) | 1 분 |
| 물로 세적 | 1 분 |
| 정섁화 | 1 분 |
| 물로 세적 | 1 분 |
| 95% 에탄을 | 1 분 |
| 에오신 | 45조 |
| 95% 에탄을 | 1 분 |
| 100% 에탄을 | 1 분 |
| 100% 에탄을 | 1 분 |
| 자원렌 | 2 분 |
| 자원렌 | 2 분 |
| 동입 |
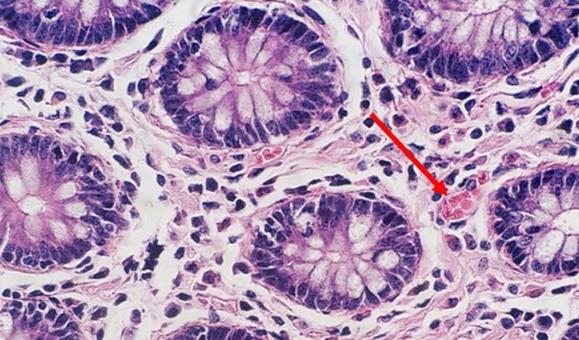
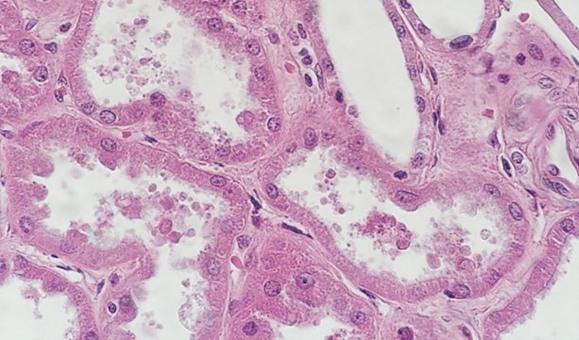
퇴행성 염색과 변형 진행성 염색을 수행하는 경우 분별제를 사용합니다. 분별제는 내부에서 제조되므로 너무 약하거나 너무 강할 수 있습니다. 두 경우 모두 염색에 영향을 미칩니다. 분별제가 예상보다 강하면 헤마톡실린이 다수 제거되어 핵이 흐려집니다. 시간도 중요합니다. 분별제를 올바르게 전처리하는 데 시간을 너무 많이 보내면 헤마톡실린이 다수 제거되어 결과적으로 핵이 염색되지 않습니다.
약산은 헤마톡실린 보관 수명에 중요합니다. 약산이 없으면 수돗물로 헹굴 때 수돗물의 알칼리성이 염료 레이크를 침전시킬 수 있는 pH를 상승킬 수 있으며 이로 인해 색상이 선홍색에서 보라색을 띈 빨간색으로 변합니다. 주기적으로 소량의 약산을 헤마톡실린에 첨가하면 적절한 pH를 유지하고 염색 수명을 연장시킬 수 있습니다.
물은 에오신의 분별제로 사용됩니다. 95% 에탄올로 에오신 단계를 수행하는 것이 일반적입니다. 에탄올은 슬라이드를 헹굴 때 사용되는 반면 물은 조직에서 초과 에오신을 제거합니다. 이 단계에서 시간을 연장하면 좀 더 밝게 염색되고 시간을 단축하면 착색이 진해져 착색을 통제할 수 있습니다. 하지만 자일렌 내 잉여 수분을 사용하여 분별 절차를 계속 진행할 수 있지만, 봉입 후 슬라이드에서 자일렌 내 잉여 수분이 분홍색 연무로 보일 수 있습니다.
모든 조직이 균일하게 생성되지 않습니다. 낭종 시료와 지방 표본을 올바르게 처리했더라도 슬라이드를 염색하면 이러한 표본은 육안으로 매우 다르게 보일 수 있습니다. 이러한 표본에는 세포에 액체나 지방이 있었던 개방 공간이 있는 경우가 많고 착색이 조직 유형의 단순한 아티팩트이면 세포벽 두께가 밝게 표시될 수 있습니다.
보다 큰 세포 표본(예: 편도선, 림프절)이 이 영향을 많이 받을 수 있습니다. 림프구에는 세포질이 적으므로 다른 조직처럼 세포 사이에 세포 물질이 거의 없습니다. 이러한 이유로 인해 헤마톡실린을 에오신과 함께 사용하면 안 됩니다. 세포가 작더라도 DNA가 모여 있고 이러한 보다 큰 세포 조직은 과대 염색으로 표시되므로 현실에서는 더 얇게 절편을 제작해야 할 수도 있습니다.
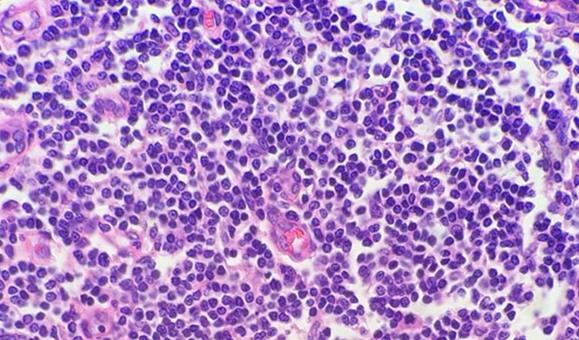
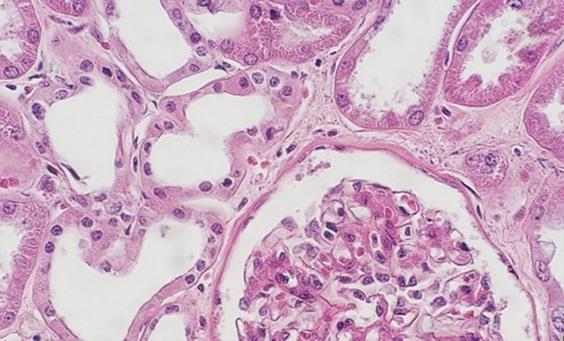
염료를 첨가하기 전에 맑고 신선한 왁스제거 시약을 사용하여 슬라이드에서 파라핀을 제거해야 합니다. 자일렌은 가장 일반적으로 사용되는 용매이지만 자일렌 대체제가 덜 유해하고 보다 경제적이므로 널리 사용되고 있습니다. 시약 오염이나 습도가 높은 환경에 관계없이 용매 내 수분은 파라핀을 제거하는 용매 성능을 저하시킵니다. 남은 파라핀은 염료가 조직에 침투하는 것을 방해하므로 균일하지 않게 염색될 수 있습니다.
이를 방지하는 가장 간단한 방법은 시약을 더욱 자주 교환하는 것입니다. 또한 건조제를 소량 첨가하면(시약 1병당 약 티스푼 한 숟갈) 용매 내 수분 오염이 줄어듭니다. 특히 자일렌 대체제를 사용할 때 이러한 조치가 중요합니다. 이러한 시약이 자일렌보다 물 오염에 약하기 때문입니다.
H&E 염색 단계별 가이드
헤마톡실린 및 에오신 염색(H&E)은 조직학과 조직병리학 실험실에서 가장 널리 사용되는 염색입니다. 올바르게 수행하면 다양한 정상 및 비정상 세포와 조직 성분을 분별할 수 있고 파라핀이나 동결 절편에서 수행할 수 있는 상대적으로 간단한 염색입니다. 조직병리학에서 경험이 풍부한 병리학자들은 H&E 염색만 사용하여 진단하는 경우가 많습니다.
처리량이 높은 실험실에서도 적은 수의 슬라이드를 효과적으로 직접 염색할 수 있습니다. 자동 슬라이드 염색기를 사용하면 성공적이면서 일관되게 염색을 수행할 수 있습니다.
일반적으로 사용하는 헤마톡실린과 에오신 공식은 다양하며 각각 다양한 장점과 단점이 있습니다. 일부 실험실에서는 자체적으로 용액을 준비하지만 시중에 판매되는 제품을 사용하기도 합니다.
개요
H&E 염색은 기관과 조직의 포괄적인 미세 해부학 결과물을 제공합니다. 헤마톡실린은 이질염색질과 핵소체를 포함한 핵 성분을 정밀하게 염색하고 에오신은 콜라겐과 탄력 섬유, 근섬유 및 적혈구를 비롯한 세포질 성분을 염색합니다. 고품질 H&E에서는 염색제, 특히 에오신에 의해 생성된 색 음영에 미묘한 차이가 있습니다. 이를 통해 질병과 관련된 형태학 변화를 검출하고 해석할 수 있습니다.
H&E 염색을 수행하고 염색 품질을 평가하는 사람은 염색 민감성, 고품질 시약을 사용하여 올바르게 염색하면 얻을 수 있는 사항 및 현미경으로 볼 수 있는 물질을 알고 있어야 합니다. 일관된 고품질 H&E 염색을 유지하는 것이 조직병리학 실험실의 기본 요구 사항입니다.
다음 섹션에서는 H&E 염색을 수행하는 기본 단계를 설명합니다.
왁스 제거
파라핀 절편을 전처리한 후 소수성인 파라핀 왁스가 모든 요소에 침투하고 주변을 에워쌉니다. 주요 세포와 조직 성분은 천연색이 아니므로 보이지 않습니다. H&E 염색을 수행하는 첫 번째 단계는 자일렌(탄화수소 용매)으로 모든 왁스를 용해하여 제거하는 것입니다.
절편 수화
왁스 제거 후 자일렌을 제거하기 위해 슬라이드를 여러 가지 알코올에 담근 후 물로 헹굽니다. 이제 수성 시약이 세포와 조직 요소에 쉽게 침투하도록 절편이 수화되었습니다.
헤마톡실린 핵 염색 적용
이제 염료(산화 헤마톡실린 또는 헤마테인)와 매염제 또는 결합제(알루미늄 염)로 구성된 용액인 Harris 헤마톡실린과 같은 핵 염색제로 슬라이드를 염색합니다. 처음에는 핵과 일부 다른 요소가 자주색으로 염색됩니다.
"청색화"로 핵 염색 완료
수돗물로 헹군 후 약알칼리성 용액으로 처리하면 절편이 "청색화됩니다". 이 단계는 헤마톡실린을 짙은 파란색으로 변환시킵니다. 이제 절편을 헹궈 대비가 충분한지 확인하여 핵이 올바르게 염색됐는지 확인하고 백그라운드 염색 정도를 평가할 수 있습니다.
여분의 백그라운드 염색 제거(분별)
Harris 헤마톡실린을 사용하는 대부분의 경우에 분별(탈색) 단계를 거쳐 비특이적 백그라운드 염색을 제거하고 대비를 향상시켜야 합니다. 약산성 알코올을 사용합니다. 이 처리 후에 다시 청색화와 헹굼을 수행해야 합니다. 탈색 또는 분별 단계가 포함된 염색 방법을 "퇴행성" 염색이라고 합니다.
에오신 대조 염색 적용
이제 절편을 개인 취향에 따라 수성 또는 알코올성 에오신 용액으로 염색합니다. 다양한 비핵 요소가 여러 가지 분홍색 음영으로 표현됩니다.
헹굼, 탈수, 투명화 및 봉입(커버 유리 적용)
에오신 염색 후 슬라이드를 여러 가지 알코올에 담가 물의 모든 미세 물질을 제거한 후 조직을 "투명화"하는 자일렌이 담긴 여러 수조에서 헹궈 완전히 투명화합니다. 폴리스틸렌 봉입제를 얇게 도포한 후 유리 커버 슬립으로 봉입합니다. 염색과 이후 모든 단계를 올바르게 수행하면 슬라이드에 중요한 모든 미세 성분이 나타나고 슬라이드는 다년간 안정적인 상태로 유지됩니다.
H&E 염색 문제 해결
H&E 염색은 상대적으로 수행하기 쉬운 염색이지만 우수한 염색 결과를 방해하는 다양한 요인이 있습니다.
아티팩트는 다양한 원인으로 인해 나타날 수 있습니다.
우수한 일반(H&E) 염색과 봉입 단계
병리학자의 조직학적 검사를 위해 환자의 조직 표본을 전처리하는 데는 세심한 주의, 역량 및 완벽한 절차가 필요합니다. 이 가이드에서는 실제 모범 사례와 일반적인 오류를 방지할 수 있는 간단한 방법을 설명합니다.
이 세션에는 일반 염색과 봉입을 향상시키는 팁을 중점적으로 설명합니다. 각 단계에서는 우수한 조직학 검사에 중요한 정보를 제공하고 수용할 수 없는 결과가 발생하는 경우 이러한 단계를 통해 문제를 해결할 수도 있습니다.
"101 Steps to Better Histology" 전문을 보고 싶습니까?
더 나은 조직처리를 위한 101 가이드를 지금 다운로드 하세요!
정확한 타이밍 사용
염색 프로토콜의 각 단계에서는 타이밍이 정확해야 합니다.
염색 단계에 소요되는 시간은 대략적이고 "급할 경우" 일부 단계를 건너뜁니다. 이렇게 해도 일관된 결과를 만들 수 있습니다.

주기적으로 품질 모니터링
대조 슬라이드를 주기적으로 염색하여 염색 품질을 모니터링합니다.
대조 슬라이드를 절대로 H&E 염색에 사용해서는 안 됩니다. 사용하면 염색 문제의 원인이 불량한 시약, 잘못된 프로토콜 또는 잘못된 고정인지 확인하기가 매우 어려워질 수 있습니다
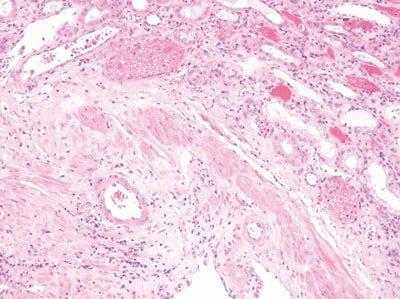
염색 조건 표준화
염색 중에 모든 단계에서 교반, 세척 및 배출 시간을 최적화합니다.
교반, 세척 및 배출 시간은 일정하지 않습니다. 용매와 시약은 빠르게 오염됩니다. 따라서 염색이 일관되지 않게 됩니다.

완벽한 왁스제거
슬라이드 왁스제거를 최적화합니다.
슬라이드 왁스제거가 완벽하게 진행되지 않아 슬라이드에 잔류 왁스 얼룩이 포함되는 경우가 있습니다. 이로 인해 염색되지 않거나 절편에서 균일하지 않게 염색된 부위가 발생합니다.
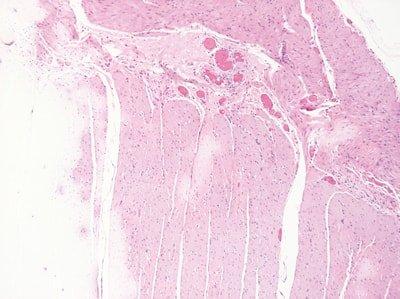
주기적으로 시약 교체
염색한 슬라이드 수와 처리된 랙을 기준으로 용매와 염색 시약을 주기적으로 교체합니다.
용매와 염색 시약 교체 주기는 일정치 않습니다. 염색 품질이 저하될 때까지 교체하지 않습니다.
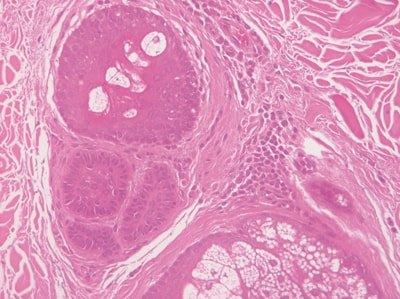
절편 전체 수화
헤마톡실린 염색 전에 슬라이드 전체를 수화합니다.
헤마톡실린 용액은 알코올과 간혹 자일렌에 의해 빠르게 오염됩니다. 이로 인해 염색이 균일하지 않게 됩니다.
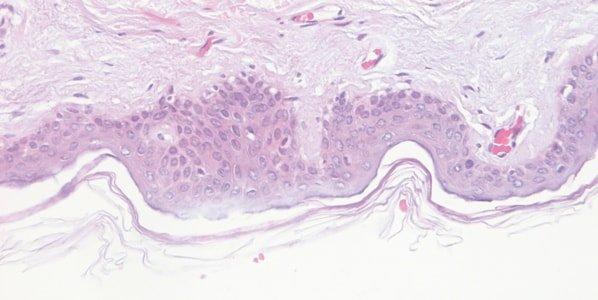
헤마톡실린 품질 모니터링
헤마톡실린 용액 성능을 주의 깊게 모니터링합니다. 헤마톡실린 용액은 슬라이드와 랙의 캐리오버(carry over)로 인해 점차 희석되고 계속되는 산화의 영향을 받습니다.
헤마톡실린 염색은 매일 변하지만 그 원인을 파악하는 것은 쉽지 않습니다. 예를 들어 염색 수조 표면 영역, 염색 중 통기 규모 및 주변 온도 모두 산화 속도에 영향을 미칠 수 있습니다.
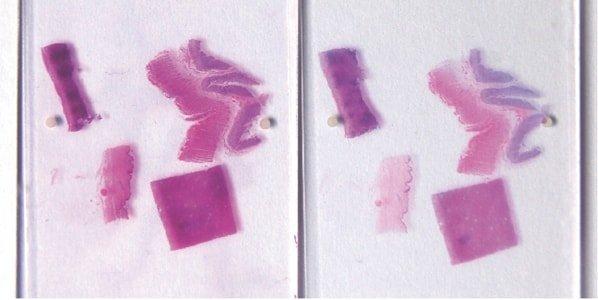
완벽한 핵 "청색화"
헤마톡실린 염색 후에 항상 Scott 알칼리성 수돗물 대체제나 암모니아수를 사용하여 핵을 "청색화"합니다. 이 요구 사항은 지역 수돗물의 pH에 영향을 받습니다.
간혹 헤마톡실린 염색 후 알칼리성 수돗물에서 "청색화"가 완벽하게 진행되지 않아 핵이 완료된 절편에서 분홍색으로 보이는 경우가 있습니다. 헤마톡실린을 사용한 염색 부족(또는 과다 분별)과 에오신을 사용한 과다 염색에서 핵이 분홍색으로 나타납니다.

균일하지 않은 에오신 염색 방지
"청색화" 후 에오신 염색을 방해하고 약하거나 균일하지 않은 염색의 원인이 되는 잔류 알칼리를 제거하기 위해 수돗물에서 철저하게 세척합니다.
"청색화" 후 세척을 잘못하면(잔류 알칼리가 남아 있음) 에오신 염색이 약하거나 균일하지 않게 됩니다.
에오신 pH 모니터링
에오신 용액의 pH를 모니터링합니다. 최적의 염색이 유지되도록 pH를 pH 5.0에 가깝게 유지합니다. 아세트산 몇 방울을 첨가하면 pH를 간편하게 낮출 수 있습니다.
에오신의 pH를 모니터링하려 하지 않습니다. 염색 강도가 저하되면 용액을 교체합니다. (알칼리성 수돗물의 캐리오버로 인해 에오신 용액의 pH가 상승할 수 있습니다.)
투명화 및 봉입 전에 철저하게 탈수
절편을 투명화하기 위해 자일렌에 담기 전에 철저하게 탈수합니다.
절편을 알코올에서 자일렌으로 급하게 옮기는 경우가 있습니다. 물에 의해 오염된 자일렌으로 투명화하면 조직 내 미세한 물방울이 있을 수 있습니다. 이 물방울은 현미경으로 보이며 이로 인해 상세하게 보이지 않는 불투명한 부위가 생깁니다.
건조 및 결정 형성 방지
봉입은 항상 절편이 건조되기 전에 적용되며 고품질 봉입제가 사용됩니다. 장기간 보관할 수 있는 봉입제 품질을 알아야 합니다. 품질이 나쁜 봉입제에서는 결정이 나타날 수 있기 때문입니다. 장기 보관(수 개월 또는 몇 년) 후에도 결정이 나타나는 경우가 있습니다.
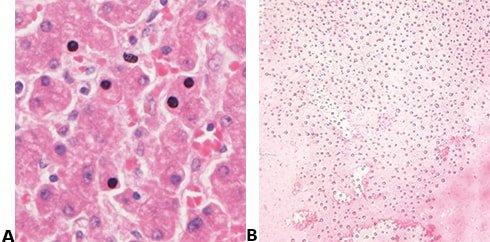
봉입하기 전에 절편이 부분적으로 건조되면 핵 일부가 검은색으로 나타납니다. 가격 기준으로만 선택한 봉입제는 장기 보관 시 결정을 형성할 수 있으며 이 결정으로 인해 봉입이 들릴 수 있습니다.
발표자 소개

Cindy Sampias is a board certified Cyto- and Histo-technologist. With more than 25 years of experience, she is a guest speaker at histology and cytology meetings around the country. She is a technical author for Media Lab, publishing a variety of technical courses and sharing best practices in histology.

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
참조 문헌
이 참고 문헌은 라이카 바이오시스템즈에서 의료 전문가들에게 서비스로 제공되는 문서이며 공개된 문헌에서 편집되었습니다. 라이카 바이오시스템즈는 정확한 정보 전달을 위해 최선의 노력을 다했지만 그 정확성에 대해서는 책임을 지지 않습니다. 이 문서는 의료 관련 조언을 제공하기 위한 목적으로 작성되지 않았으며 그러한 의미로 해석되어서는 안 됩니다. 모든 용도에 있어 다양한 약물 및 장치의 제품 정보 가이드, 부속 자료 및 사용 설명서를 참조해야 합니다. 라이카 바이오시스템즈와 편집팀은 이 참조 문서에 기술된 약물, 장치, 기술 또는 절차 사용으로 인해 직접 또는 간접적으로 발생하는 모든 책임을 부인합니다.
Related Content
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.



