
정상 피부와 병리학적 피부에서 혈액응고인자 XIIIa 발현


혈액응고인자 XIIIa는 트롬빈 및 Ca2+과의 상호작용의 결과로 응고 연쇄반응의 최종 단계의 활성화 성분이 되는 혈액 응고 프로토트랜스글루타미나아제 (prototransglutaminase)인데요. FXIIIa는 혈액 및 세포 내에서 생성되는 응고인자로 다양한 세포 유형에서 광범위하게 발현되는데요. 또한 응고 연쇄반응의 최종 단계와 상처 치유 및 복구에 중요한 역할을 수행하는 FXIIIa는 배아 착상 시 혈관신생에도 정상 피부에서는 단핵구/대식세포 또는 섬유아세포 계통에서 유래하는 진피 가지 세포에서도 광범위하게 발현됩니다. 이들 세포는 진피-표피 경계부에서 유두 진피에 주로 위치하며 피부 부속기관과도 관련이 있지만 일반적으로 표피 내에는 있지 않습니다. FXIIIa 양성 세포 수의 상승은 편평태선 및 건선을 포함한 여러 피부 염증 질환에서 나타날 수 있는데 이것은 종양 병리학의 응용 분야에서 피부섬유종(dermatofibroma, DF)과 기타 섬유조직 구성 종양의 숙주, 특히 융기성 피부섬유육종 (dermatofibrosarcoma protuberans, DFSP) 간의 면역 표현형적 차이를 구별하는 데 도움을 줍니다.
소개
FXIIIa는 섬유소 안정화에서 중요한 역할을 하며 상염색체 열성 질환인 선천성 FXIII 결핍의 중증 출혈 증상의 결과로 섬유소 안정화 결함이 입증될 수 있습니다. 이 효소는 혈장 형태에서 A 및 B 아단위 쌍(A2B2)으로 구성된 이종사 합체로써 조직 또는 세포 형태에서 해당 단백질은 B 아단위가 없으므로 구조적으로 A 아단위(A2)의 동종이합체라고 할 수 있습니다. 유전자 연구에서 A 및 B 아단위의 유전자 암호화를 각각 염색체 6p24–25와 1q31–32.1에 매핑한 결과, 인간 혈액응고인자 XIIIa에 대해 cDNA 암호화를 이용한 태반 조직에 대한 연구에서 분리된 혈액응고인자 XIIIa cDNA의 크기는 염기 3905개로 구성된 것으로 나타났으며 이는 732개 아미노산으로 구성된 하나의 단백질을 암호화합니다. 게다가 골수 기원 세포는 혈장 FXIII에서 아단위 A의 합성을 위한 일차 부위인 것으로 여겨지며, 간 내 간세포도 관련이 있었습니다. 혈장 FXIII의 아단위 B는 간에서 합성되는데요.
FXIII은 혈괴 형성에서 기능적 항상성 역할을 하는 동시에 상처 치유와 혈관 형성 경로를 수반하는 배아 착상 과정에서 중요한 역할을 합니다. 3 상처 치유의 경우4, FXIIIa는 복구 과정 동안 혈관 내피 투과성을 감소시키는 데 중추적인 것으로 여겨지며5, 특히 만성 정맥 기능부전으로 인해 발생하는 당뇨병성 상처에서 혈관 투과성 증가의 치료에 있어 잠재적인 새로운 전략입니다. 배아 착상 측면에서 FXIII은 건강한 임신을 유지하는 데 필수적인 친혈관신생 특성을 가지는 것으로 여겨집니다.
조직 절편에서 FXIIIa의 항체 입증이라는 개념은 Cerio와 Headington의 중대한 출판물에서 소개된 후 1980년대 후반부터 이용 가능하게 되었는데요. 정상 조직에서의 FXllla의 분포는 광범위하며, Derrick 등의 출판물에 따르면 피부, 식도, 위, 소장, 대장, 방광, 폐, 신장, 간, 비장, 고환, 갑상선을 포함하여 평가한 모든 장기 유형에서 FXIIIa 양성 세포가 발견되었습니다. 경험상 FXIIIa 양성 세포는 훨씬 더 광범위한 조직 유형, 특히 피막성 림프 구조, 특히 그러한 조직을 둘러싸거나 그러한 조직으로 관통하는 결합 조직(특히 부비동 내벽 세포)이 있는 조직 유형에서 관찰될 수 있으며 지방 소엽 사이의 격막에서 높은 수치가 관찰된 바 있습니다. 하지만 정상 상태에서 FXIIIa 세포 수치 상승은 피부 및 점막 조직(위장관 및 방광)에서 관찰될 수 있으며, 간, 갑상선, 고환, 비장과 같은 부위는 비교적 낮은 수치만을 보입니다. 이에 유의한 이론적 근거로는 조직 내에서 FXIIIa 세포 수 증가는 세포의 면역반응에서 중요한 역할을 한다는 것인데요. 피부에서 양성 세포의 분포는 진피로 국한되며 유두 진피 내(그림 1), 진피-표피 경계부, 부속기 주위의 느슨한 유륜 결합 조직, 특히 털 피지샘 단위와 혈관 주위에서 유의한 수가 기록됩니다.
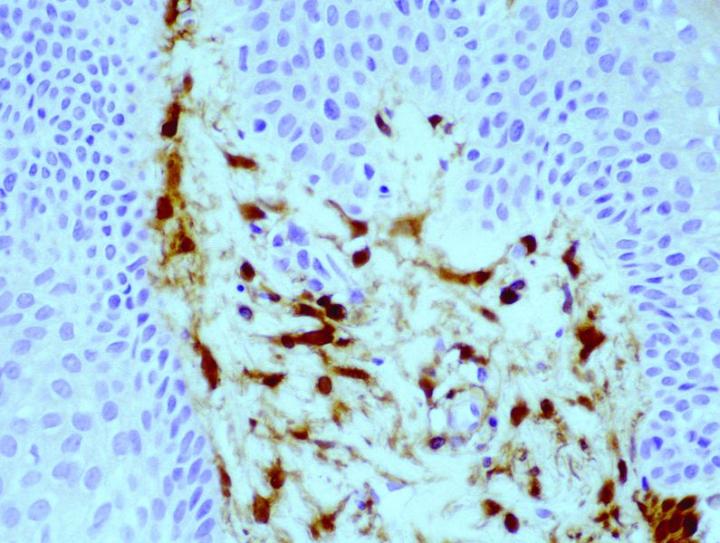
항원 결정인자는 주로 세포의 세포질에 국부적으로 나타나는 것으로, 약간의 막 표지가 보고되었습니다.8 FXIIIa 세포는 세포의 위치에 따라 구조적 외양이 다른 것으로 보이기도 하는데요. 피부의 진피-표피와 경계부에서 이러한 세포는 크고 경계선이 있는 수지상세포로 나타나는데 마치 눈에 띄는 세포체 처럼 점점 가늘어지고 대부분 표피를 향하고 있는 세포 돌기를 가지고 있습니다. 반면 진피 내에 더 깊이 위치한 세포는 좁고 더 많은 수로 응집되어 있으며 수지상 돌기는 덜 두드러지는데요. 이 세포들은 그 두드러진 외관으로 인해 기술적 식별 용어로 “진피 가지 세포”로 불리게 되었으며 헤딩턴에 의해 처음 사용되었습니다.9
이러한 골수 기원 세포는 항원 제시 세포 특성을 나타내는 다른 세포들과 유사하지만 랑게르한스 세포와는 구별되는 특별한 조직효소적 및 면역조직화학적 특성을 가지고 있습니다. 6 이들은 실제로 CD1a를 발현하지 않으며, 표피 세포의 2~8%를 차지하는 골수 기원성 세포인 랑게르한스 세포와는 달리 포식작용을 하는 것으로 나타났는데요.8 예비 연구에 따르면, 진피 가지 세포는 섬유아세포 계통에서 유래되지 않은 것으로 나타났으며 섬유아교성 피부 질환에서 FXIIIa에 대한 음성 표지는 초기의 관점을 재확인하는 기회가 되었습니다.6 & 8 반대로, Nemet 등 은 코의 섬유성 구진, 후천성 수지 섬유각화종, 혈관 섬유종, 구강 섬유종의 수지상 섬유아세포에서 FXIIIa 양성을 보고하였는데요. 이 연구의 관찰 결과는 FXIIIa가 비슷한 계열의 종양에서 성장인자로 작용할 수 있거나, 정의되지 않은 자극에 대한 반응 또는 FXIIIa의 과잉생산의 결과로 종양이 발생할 수 있음을 시사하는 것입니다. 더욱이10 FXIIIa 양성 세포 수의 증가는 종종 기저부 또는 침습적 피부 종양 주변에서 발견되며, 해당 세포는 CD68과 같은 통상적인 대식세포 표지자에는 때때로 음성인 것이 관찰되었습니다.
결론적으로 FXIIIa 양성 세포, 특히 단핵구/대식세포 계통의 세포 (OKM5+, Mo1+, Mono1+ 및 Leu M3+)와 특정 세포 표면 표지자를 공유합니다. 인간 단핵구의 장기 배양물에서는 FXIIIa 유전자 발현 및 단백질 생성에 대해 실시한 최근의 연구에 따르면 전형적 활성화 경로 또는 대안적 활성화 경로를 유도하여 단일 세포 수준에서 정량적 RT-PCR 및 형광 영상 분석을 이용했을 때, mRNA 및 단백질 수준 모두에서 FXIIIa의 발현이 두 활성화 경로 동안 역 조절되는 것으로 나타났습니다. 여기에 Torocsik 등 은 11FXIIIa 발현이 대안적으로 활성화된 대식세포에 대한 표지자이면서 FXIIIa의 부재는 단핵구 유래 대식세포에서 활성화 상태의 지표라고 결론지었습니다.
대체로, 병리학적 피부 상태에서 FXIIIa 양성 세포는 염증 상태에서의 발현과 종양 병리학에서의 발현으로 나뉠 수 있는데요.6 & 8 염증 상태 측면에서 FXIIIa 발현은 해면상 피부염 및 건선과 같은 질환에서 상승되는데 급성 및 만성 이식편대숙주병 (graft-versus-host disease, GVHD)에서는12 FXIIIa 양성 세포의 발현이 증가하며 급성(감소)13 및 만성 형태(증가) 간의 차이를 나타내는 보고가 있었습니다. 또한 대부분의 상태에서는 랑게르한스 세포(CD1a) 양성 수의 증가도 검출되었는데요. 다른 염증 세포와 관련해 만성 판상 건선 환자의 경우,8 표피 구획으로의 FXIIIa의 양성 세포 이동이 보고되었으며 이는 세포가 피부 내에서 APC 역할을 한다는 개념을 뒷받침하는 것입니다.
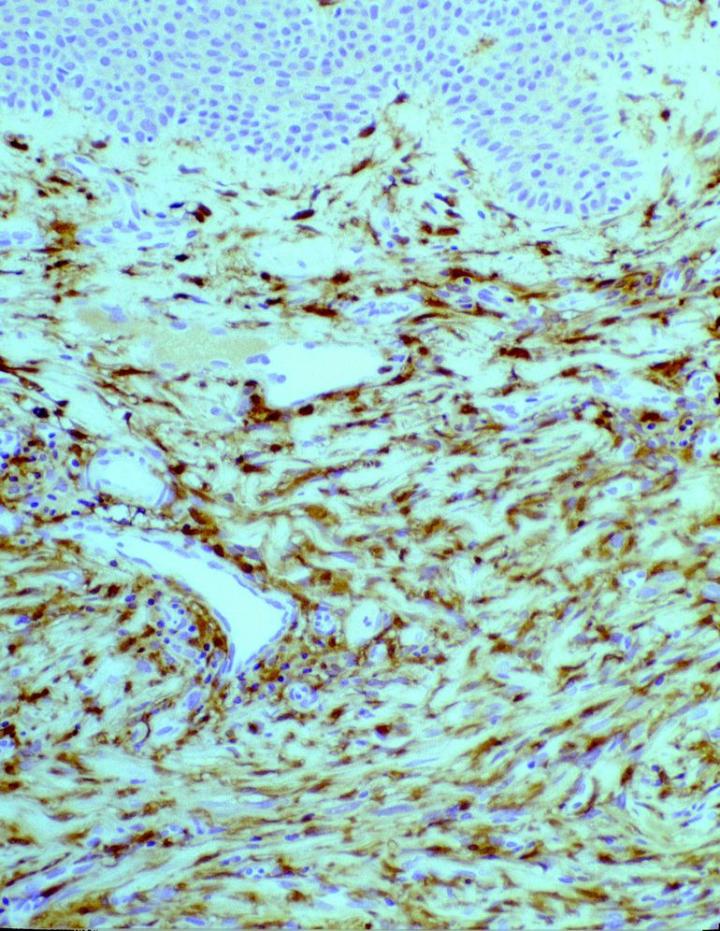
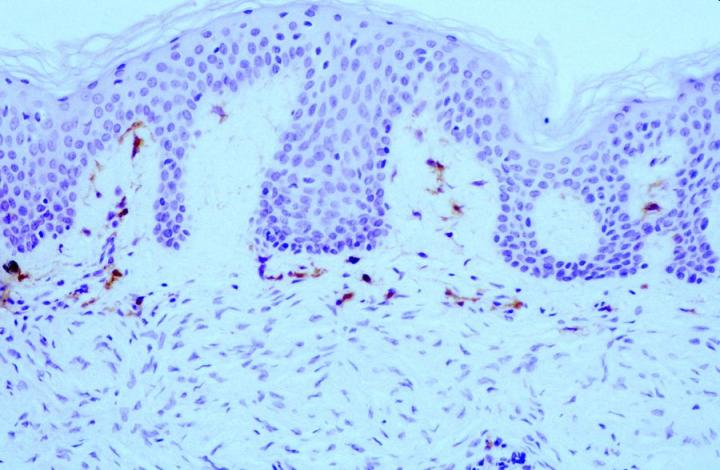
뿐만 아니라 종양 병리학에서는 14 and Cerio et al15FXIIIa가 특정 피부 중간엽 종양에서 가치를 발견하였는데 Jones와 Cerio 이 발표한 초기 보고서 볼 수 있듯이 상피세포 조직구종과 피부섬유종에서 FXIIIa 가 증가한 것으로 나타났습니다(그림 2,3 참고).
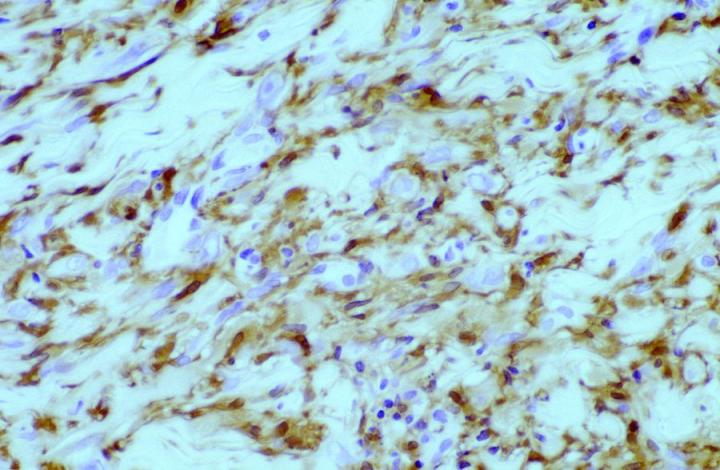
이때 구성되는 종양 세포 군집의 약 50%가 두 논문에서 양성으로 보고되었는데요. 표지는 병변의 중심으로 갈수록 더 약해진 것으로 확인되었습니다. 이 관찰 결과는 피부섬유종(DF)이 융기성 피부섬유육종(DFSP)과 구별된다는 맥락에서 매우 유용하다고 할 수 있습니다. 또한 DF 와 DFSP의 조직학적 양상의 변화는 광범위한 것으로 감별 진단이 어려울 수 있으나 면역표현형 DFSPÕ는 CD34 양성(그림 4 및 5)인 반면 피부섬유종은 FXIIIa를 발현합니다.
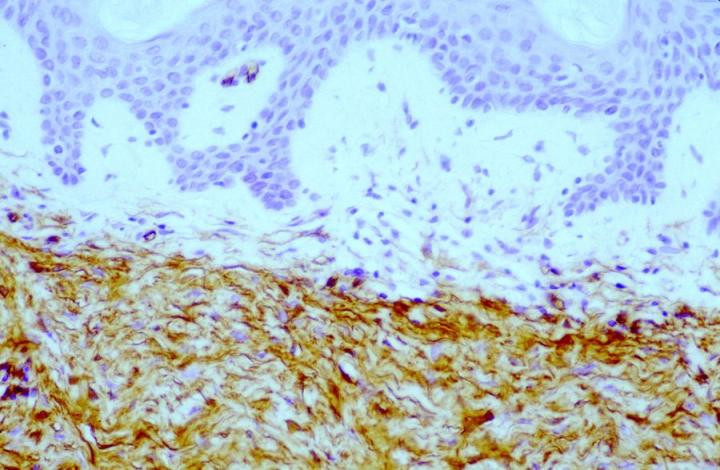
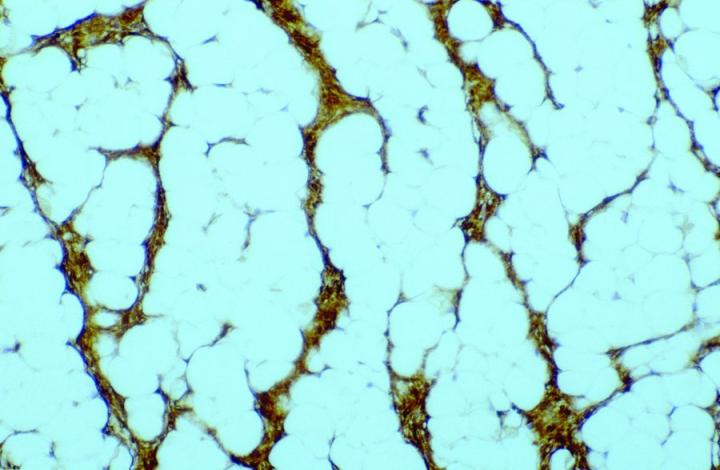
DFSP 내 반점형 FXIIIa 표지가 관찰될 수 있으나, 실제로 양성 세포는 대부분의 경우 그림 6과 같이16 포착된 비신생물 진피 가지 세포이거나 침습성 종양 세포의 주변부를 둘러싸고 있습니다. 일부는 DF에서 CD34의 국소 표지도 볼 수 있는 반면에 그 유의성은 여전히 명확하지 않습니다.
DF에서 FXIIIa 양성 세포에 대해 면역전자현미경 검사를 실시한 결과, 이 세포들이 중등도 내지 풍부한 조면 세포체, 지질 방울 및/또는 다발 또는 근육잔섬유를 다양한 비율로 보인다는 점에서 진피 가지 세포와 유사한 것으로 나타났는데요.17 또한 이웃 세포들 간의 반점성 유착 연결의 증거가 있습니다. 악성 섬유 조직구조(fibroushistiocytoma, MFH)에 대한 연구에서, 세포 내 FXIIIa 발현은 가변적인 정도로 드러났습니다.18
이러한 종양은 광범위한 조직학적 양상을 보이는 동시에 이들 모두는 방추상 섬유모세포 유사 세포, 미분화 세포, 조직구 또는 조직구 유사 세포의 변이로 FXIIIa 양성 세포는 다양한 수준의 섬유 조직구 분화를 나타내며 실제로 섬유 조직구 전구세포라고 할 수 있습니다.19, 20
FXIIIa는 또한 파종성 황색종21, 황색 육아종과 같은 일련의 비-랑게르한스 세포 조직구증에 속하는 여러 종양에서 광범위하게 발현되기도 하는데요. FXIIIa는 젊은 성인의 머리와 목 부위에서 흔히 발생하는 비교적 드문 양성 피부 신생물인 세포성 신경초점액종에서 양성으로 보고되었습니다.22 FXIIIa 양성 세포는 또한 피부의 과립세포 종양에서도 보고되었으며 면역조직화학 및 전자 현미경 검사에 근거, 대부분의 피부 과립세포 종양은 슈반세포에서 기원합니다.
피부의 과립세포 종양에서 FXIIIa 양성 세포의 존재는 곧 슈반 세포종 군에서 종양이 예외일 수 있음을 시사하는 바이며 FXIIIa의 발현은 카포시 육종의 방추상 세포에서 유의해야 하는데요. 카포시 육종은 종종 다병소성이고 다발성 장기 침범을 수반하나, 매우 흔하게 피부에 영향을 미치는 신생물로 진피 가지 세포의 존재는 이 같은 특정 질환에서 혈관 증식 반응에 중요할 수 있습니다.23
발표자 소개

Guy Orchard is a Consultant Grade Biomedical Scientist and Laboratory Manager at Viapath, St John's Institute of Dermatology, London. He has been a council member for the Institute of Biomedical Science (IBMS) and is currently a specialist advisor for cellular pathology and the Deputy Chief Examiner for Cellular Pathology for the IBMS. In 2015, Guy was awarded the Leica Leadership Award for Teaching by the National Society for Histotechnologists.”

Catherine Stefanato is a Dermatopathology Consultant in the Department of Dermatology at St. John's Institute of Dermatology, London, UK. Dr. Stefanato completed her residency training in Dermatology at the Catholic University of the Sacred Heart in Rome, Italy. She undertook residency training in Anatomic Pathology at Yale University School of Medicine (USA), followed by Fellowship training in Dermatology at the Boston University School of Medicine, where she also worked as a Consultant Dermatopathologist and Assistant Professor of Dermatology and Pathology. Dr. Stefanato is a Diplomate of the American Boards of both Anatomic Pathology and Dermatology.
참조 문헌
- Muszbek l, Adany R, Mikkola H. Novel aspects of blood coagulation factor XIII. I. Structure, distribution, activation, and function. Crit Rev Clin Lab Sci 1996; 33 (5): 357–421.
- Grundmann U, Amann E, Zettlmeissi G, Kupper HA. Characterization of cDNA coding for human factor XIIIa. Proc Natl Acad Sci USA 1986; 83 (21): 8024–8.
- Wozniak G, Noll T. Factor XIII and wound healing. Hamostaseologie 2002; 22 (1): 59–62.
- Tosetto A, Castaman G, Rodeghiero F. Acquired plasma factor XIII deficiencies. Haematologica 1993; 78 (6 Suppl): 5–10.
- Inbal A, Dardik R. Role of coagulation factor XIII (FXIII) in angiogenesis and tissue repair. Pathophysiol Haemost Thromb 2006; 35 (1–2): 162–5.
- Cerio R, Griffiths CE, Cooper KD, Nickoloff BJ, Headington JT. Characterization of factor XIIIa positive dermal dendritic cells in normal and inflamed skin. Br J Dermatol 1989; 121 (4): 421–31.
- Derrick EK, Barker JN, Khan A, Price ML, Macdonald DM. The tissue distribution of factor XIIIa positive cells. Histopathology. 1993; 22 (2): 157–162.
- Cerio R, Spaull J, Oliver GF, Jones WE. A study of factor XIIIa and MAC 387 immunolabeling in normal and pathological skin. Am J Dermatopathol 1990; 12 (3): 221–233.
- Headington JT. The dermal dendrocyte. Adv Dermatol 1986; 1: 159–171.
- Nemeth AJ, Penneys NS. Factor XIIIa is expressed by fibroblasts in fibrovascular tumors. J Cutan Pathol 1989; 16 (5): 266–71.
- Torocsik D, Bardos H, Nagy L, Adany R. Identification of factor XIII-A as a marker of alternative macrophage activation. Cell Mol Life Sci 2005; 62 (18): 2132–9.
- Yoo YH, Park BS, Whitaker-Menezes D, Korngold R, Murphy GF. Dermal dendrocytes participate in the cellular pathology of experimental acute graft-versus-host disease. J Cutan Pathol 1998; 25 (8): 426–34.
- Deguchi M, Aiba S, Ohtani H, Nagura H, Tagami H. Comparison of the distribution and numbers of antigen-presenting cells among T-lymphocyte-mediated dermatoses: CD1a+, factor XIIIa+, and CD68+ cells in eczematous dermatitis, psoriasis, lichen planus and graft- versu s_host disease. Arch Dermatol Res 2002;294(7):297-302.
- Jones EW, Cerio R, Smith NP. Epithelioid cell histiocytoma: a new entity. Br J Dermatol 1989; 120 (2): 185–95.
- Cerio R, Spaull J, Jones EW. Histiocytoma cutis: a tumour of dermal dendrocytes (dermal dendrocytoma). Br J Dermatol 1989; 120 (2): 197–206.
- Goldblum JR, Tuthill RJ. CD34 and factor-XIIIa immunoreactivity in dermatofibrosarcoma protuberans and dermatofibroma. Am J Dermatopathol 1997; 19 (2): 147–53.
- Song Y, Sakamoto F, Ito M. Characterization of factor XIIIa+ dendritic cells in dermatofibroma: Immunohistochemical, electron and immunoelectron microscopical observations. J Dermatol Sci 2005; 39 (2): 89–96.
- Nemes Z, Thomaszy V. Factor XIIIa and the classic histiocytic markers in malignant fibrous histiocytoma: a comparative immunohistochemical study. Hum Pathol 1988; 19 (7): 822–9.
- Zelger B, Cerio R, Orchard G, Fritsch P, Wilson-Jones E. Histologic and immunohistochemical study comparing xanthoma disseminatum and histiocytosis X. Arch Dermatol 1992; 128 (9): 1207–12.
- Zelger BG, Orchard G, Rudolph P, Zelger B. Scalloped cell xanthogranuloma. Histopathology 1998; 32 (4): 368–74.
- Mahalingam M, Alter JN, Bhawan J. Multiple cellular neurothekeomas – a case report and review on the role of immunohistochemistry as a histologic adjunct. J Cutan Pathol 2006; 33 (1): 51–6.
- Nikkels AF, Arrese Estrada J, Pierard-Franchimont C, Pierard GE. CD68 and factor XIIIa expressions in granular-cell tumor of the skin. Dermatology 1993; 186 (2): 106–8.
- Nickoloff BJ, Griffiths CE. The spindle-shaped cells in cutaneous Kaposi’s sarcoma. Histologic simulators include factor XIIIa dermal dendrocytes. Am J Pathol 1989; 135 (5): 793–800.
라이카 바이오시스템즈 Knowledge Pathway 콘텐츠는 에서 이용할 수 있는 라이카 바이오시스템즈 웹사이트 이용 약관의 적용을 받습니다. 법적고지. 라이카 바이오시스템즈 웨비나, 교육 프레젠테이션 및 관련 자료는 특별 주제 관련 일반 정보를 제공하지만 의료, 규정 또는 법률 상담으로 제공되지 않으며 해석되어서는 안 됩니다. 관점과 의견은 발표자/저자의 개인 관점과 의견이며 라이카 바이오시스템즈, 그 직원 또는 대행사의 관점이나 의견을 나타내거나 반영하지 않습니다. 제3자 자원 또는 콘텐츠에 대한 액세스를 제공하는 콘텐츠에 포함된 모든 링크는 오직 편의를 위해 제공됩니다.
모든 제품 사용에 다양한 제품 및 장치의 제품 정보 가이드, 부속 문서 및 작동 설명서를 참조해야 합니다.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.