
標本処理の手引き

パラフィン切片のための組織処理ステップの概要
細胞および組織の顕微鏡解析には、正常および異常な構造がはっきり分かるように適切に染色され、ガラススライドにマウントされた極めて薄くて高品質の切片(スライス)の作製が必要です。
大部分の新鮮な組織は、非常にデリケートで、簡単に変形したり損傷を受けるので、化学的に保存すなわち「固定」し、薄切する際に何らかの方法でサポートしない限り、薄い切片を作製することは不可能です。大きく分けて、このサポートを提供するために利用できる2つの戦略があります。
- 組織を凍結し、凍結したまま切片を薄切することができます。これらの切片は 「凍結切片」と呼ばれます。
- 適切な物理的性質を有する固体に変換することができる液剤を、組織標本に浸透させ、これにより薄切することができるようになります。パラフィンワックスはそのような薬剤の内の一つです。このようにして「パラフィン切片」が作成されます。
この記事では、切片の作製に用いることができるパラフィン包埋標本を作製するための組織処理方法について説明します。
はじめに
「組織処理」とは、動物やヒトの組織を、固定から、適切な組織学的検査用ワックスで完全に浸潤し、包埋してミクロトームで切片作製をする準備ができている状態にするまでに必要な手順のことです。
組織処理は手作業で行うことができますが(手処理)、複数の標本を処理する必要がある場合は、自動組織処理機(「ティッシュプロセッサー」)を使用するほうが便利ではるかに効率的です。これらのデバイスは1940年代から利用可能でしたが、1 徐々に進化しており、使用の安全性が向上し、多数の検体をより迅速に処理し、より良い品質の結果を生み出すようになっています。プロセッサーには主に2つのタイプがあります。1 つは、標本を容器から別の容器に移して処理する組織移送タイプ(または「ディップアンドダンク」)、もう1つは液体移送(または「密閉」)タイプで、標本が単一のプロセスチャンバーまたはレトルトに保持され、液体が必要に応じてポンプで出し入れされます。最新の液体移動処理装置の多くは、効果的な高温の液体循環方式を採用し、真空/圧力サイクルを組み込むことによって、処理手順を向上させ、処理時間を短縮しています。
最新の密閉型ティッシュプロセッサー



組織処理の重要性
ほとんどの検査室の監督者は、組織処理の重要性をスタッフに強調します。不適切な処理スケジュールを使用したり、根本的な間違いを犯したりすると(処理試薬の交換や順番など)、切片にすることのできない組織標本が作製され、いかなる有用な顕微鏡情報も得られなくなってしまうことを強調しておくことには価値があります。標本全体が処理された(「オールイン」)診断用のヒト組織を扱っている場合、これは悲惨な結果になる可能性があります。予備の組織はありません。診断はできません。しかし、患者には説明しなければなりません。
ティッシュプロセッサーでも機械的または電気的な障害が時々発生しますが、組織が実際に障害を受ける処理事故は、主に人為的エラーが原因で発生します。組織処理を行う人々に対する適切な教育とトレーニングの価値を強調すること、および処理実行のためにプロセッサーを設定する際に、特別な注意を払う必要があることを強調することが重要です。
パラフィン切片のための組織処理ステップの概要
1. 新鮮な標本の入手
新鮮な組織標本のソースはさまざまです。新鮮な組織標本は、患者や実験動物から摘出中に極めて容易に損傷を受ける可能性があることに注意しなければなりません。摘出後は、注意深く取り扱い、できるだけ早く適切に固定することが重要です。理想的には、固定は取り出した場所(恐らく手術室)で、またはこれが不可能な場合は検査室へ輸送した直後に行う必要があります。
2. 固定
標本を、 ホルムアルデヒド溶液(ホルマリン)などの液体固定剤(固定液)に入れます。固定液はゆっくりと組織に浸透し、化学的および物理的変化を引き起こし、組織を硬化・保持し、その後の処理ステップから保護します。2 固定 に使用できる試薬の数は限られています。というのは、この目的に適した特定の性質を備えている必要があるためです。たとえば、組織成分は、後で特定の染色技術を適用できるように、化学反応性を保持する必要があります。3ホルマリンは、通常リン酸緩衝液として、パラフィン切片作製用に処理される組織を保存するために用いられる最も一般的な固定液です。理想的には、標本は固定液が組織のすべての部分に浸透するのに十分な時間(固定の化学反応が平衡に達するための追加の時間(固定時間))、固定液中に留まる必要があります。これは、通常、標本を6~24時間固定する必要があることを意味します。ほとんどの検査室では、固定ステップをプロセッサーの最初のステーションとして使用します。
固定後、標本は検査のための適切な領域を選択するために、さらに切り出しが必要になる場合があります。処理される標本は、適切なラベル付きカセット(小さな穴あきバスケット)に入れられ、他の標本から隔離されます。標本処理に使用する処理スケジュールの時間は、標本のタイプと標本寸法の最大値と最小値、使用するプロセッサー、選択した溶媒、溶媒温度およびその他の要因によって異なります。次の例は、ライカの高速ティッシュプロセッサーPELORISでの使用に適した6時間のスケジュールに基づいています。
3. 脱水
溶融パラフィンワックスは、疎水性(水と混ぜることができない)のため、ワックスに浸透させる前に標本内の大部分の水を除去する必要があります。このプロセスは通常、標本を一連のエタノール(アルコール)溶液に浸し、水を含まない純粋なアルコールに到達するまで濃度を増加させることによって行われます。エタノールと水とはどのような比率でも混和するため、試料中の水は徐々にアルコールに置き換わります。アルコールの濃度を連続して上げていくことで、組織が極端に歪むことを防止しています。
厚さが4 mm以下の標本の典型的な脱水の順序は次のとおりです:
- 70%エタノール 15分
- 90%エタノール 15分
- 100%エタノール 15分
- 100%エタノール 15分
- 100%エタノール 30分
- 100%エタノール 45分
この時点で、わずかに残った強く結合した(分子)水を除いて、すべての水が標本から取り除かれているはずです。
4. 透徹
組織はこの時点で基本的に水を含んでいませんが、パラフィンとエタノールはほとんど混和しないのでパラフィンを浸透させることはまだできません。したがって、エタノールとパラフィンのいずれとも完全に混和できる中間溶媒を使用する必要があります。このような溶媒は、組織内のエタノールに置き換わり、次に溶融パラフィンワックスに置き換えられます。この処理段階は「透徹」と呼ばれ、使用される試薬は「透徹剤」と呼ばれます。「透徹」という用語が選ばれたのは、多くの透徹剤(すべてではありませんが)が比較的高い屈折率のをもつために組織に光学的透明性を与えるからです。透徹剤のもう1つの重要な役割は、ワックス浸透の障害となる脂質の大半を組織から除去することです。
一般的な透徹剤はキシレンであり、エタノールを完全に置換するには複数回の交換が必要です。
厚さが4 mm以下の標本の典型的な透徹の順序は次のとおりです:
- キシレン 20分
- キシレン 20分
- キシレン 45分
5. パラフィン浸透
この時点で、適切な組織学的検査用パラフィンを組織に浸透させることができます。長年にわたり多くの異なる試薬がこの目的で評価・使用されてきましたが、パラフィンワックスベースの組織学的検査用パラフィンが最も一般的です。典型的なパラフィンは60°Cで液体であり、この温度で組織に浸透できます。その後、20°Cまで冷却すると固化し、切片を着実に薄切できる固さになります。これらのワックスは、精製パラフィンワックスとスチレンやポリエチレンなどの樹脂を含むさまざまな添加剤との混合物です。これらのパラフィン製剤が、非常に特別な物理的特性を備えていることは評価されるべきでしょう。この特性により、パラフィンが浸透した組織は、少なくとも2 µmまでの厚さで切片にすることができ、回転式ミクロトームで切片が薄切されるときにはリボンを形成し、温水バスに浮かせた際に、十分な弾性を維持して完全に平らになるのです。
厚さが4 mm以下の標本の典型的な浸透の順序は次のとおりです:
- パラフィン 30分
- パラフィン 30分
- パラフィン 45分
6. 包埋
標本にパラフィンが完全に浸透したので、切片を薄切するために、ミクロトームに固定できる「ブロック」に成形する必要があります。このステップは、 「包埋センター」 を使用して実行されます。そこでは、モールドに溶融ワックスが充填され、その中に標本が配置されます。標本の向きをモールド内で非常に注意深く調整します。その理由は、標本の配置によって「切片の面」が決定されるためです。切片の面は、診断と研究、いずれの組織学的検査においても熟慮すべき重要事項です。カセットをモールドの上に置き、ワックスを追加した後、冷却されたプレート上に置いて固めます。その後、カセットが取り付けられたブロックをモールドから取り外し、 ミクロトームへの準備が整います。組織処理が適切に行われている場合、組織標本を含むワックスブロックは非常に安定しており、記録資料の重要なソースであることにご留意ください。


「キシレンフリー」の処理
キシレンは組織処理用の透徹剤として広く使用されていますが、毒性のある試薬であり、一部のラボではイソプロパノールや他のキシレン代替品など、毒性の低い代替品を使用することを好みます。この方法を成功させるには、浸透中にイソプロパノールを標本から除去できるように、より高いパラフィン温度が必要です。

固定と処理を組み合わせた効果は組織を硬化させることですが、収縮が生じることは避けられません。ワックスが浸透するまでに、組織は20%以上収縮すると推定されています4このような影響はありますが、最適に処理され、組織から 作製された切片 は、一貫して優れた形態学的詳細を示し、標本間で比較を行うことができ、正確な組織病理学的診断を行うことができます。
理論上も実際上も、薄切が最も容易なパラフィンブロックとは、柔らかく固さが比較的均質な組織(腎臓など)を含み、パラフィンを浸透させても、固化したパラフィンのみ(組織を含まない)の固さと同様になります。高密度または繊維状の組織、または硬組織と軟組織の両方が別々の層に存在する標本は、固化したワックスによって一部が十分にサポートされていないため、多くの問題を引き起こす可能性があります。固定および処理中に生じるブロック内のさまざまな成分の収縮の差が問題の原因であり、薄切時にこれらの問題を経験することになる可能性があります。
処理と包埋の改善手順
患者から病理医まで、組織学的検査のために組織標本を作製するには、注意、スキル、および適切な手順が必要です。「より良い組織学的検査のための101のステップ」では、一般的なエラーを回避する技術のベストプラクティスと簡単な方法に関する実践的なアドバイスを提供しています。
このガイドでは、組織処理と包埋を改善するためのヒントを明示します。各手順が、良い組織学的検査を行う上での重要な注意喚起となり、好ましくない結果が発生した場合のトラブルシューティングとしてお役立ていただけることを願っています。
「より良い組織学的検査のための101のステップ」は
ステップ20 - 適切なスケジュールを使用する
組織の種類とサイズに応じて適切なスケジュールを選択します。
不適切なスケジュールが選択されています。たとえば、小さな内視鏡生検に対する非常に長いスケジュールや、大きな脂肪の多い乳房標本に対する非常に短いスケジュールなどです。
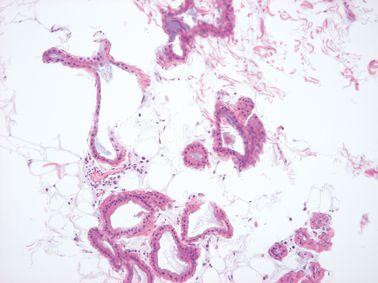
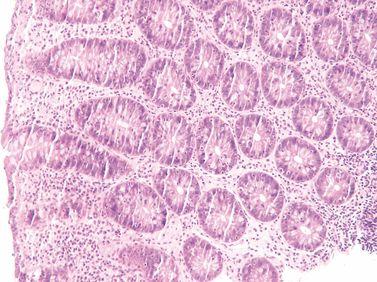
ステップ21-固定を追加する
最適な処理と良好な組織形態を得るためには、処理前に組織をしっかり固定する必要があります。標本が完全に固定されていない場合、ホルマリン固定を処理スケジュールに追加します。
固定が不完全であった標本は、直接アルコールに移し、不均一な固定を生じさせます(標本の外側はホルマリンで固定され、より深い領域はアルコールで固定されています)。
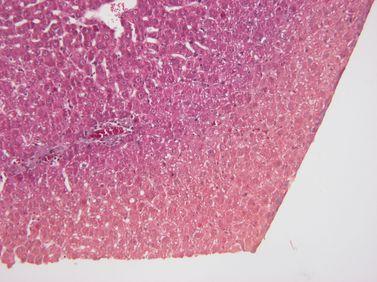
ステップ22 - 試薬の品質を維持する
処理試薬は、確立されたガイドラインに従って厳密に交換します(理想的には、ライカのPELORISなどの高度なティッシュプロセッサーの試薬管理システムを使用して)。
処理試薬の交換に関するガイドラインが無視されています。つまり、効果のない、汚染された、または希釈された試薬が使用されています(例えば、PELORIS試薬管理システムからの「閾値を超えています」という警告が無視されています)。これにより、処理品質が低下する可能性があります。
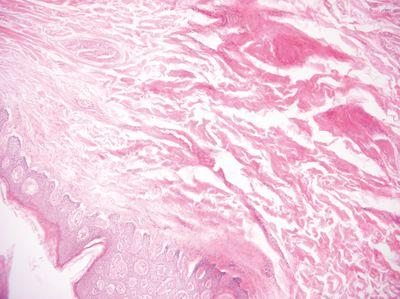
ステップ23 - 高品質のワックスを使用する
高品質のワックスを、浸透、特に包埋(ブロックアウト)に使用し、切断しやすい高品質のブロックを確保します。
あまり知られていない供給源からの安価で質の悪いワックスを浸透と包埋に使用します。低品質のワックスは、薄切が難しいブロックを生成します。

ステップ24 - 危険な試薬を避ける
可能な場合は、キシレンを使わないプロトコルを用います(Leica BiosystemsのPELORISを使用するときに利用可能なプロトコルなど)。これにより、処理品質を損なうことなく、より安全な検査室の環境が得られます。
キシレンの使用による健康への影響が考慮されていない。代替案を使用する可能性が考慮されていない。

ステップ25 - 標本の向きを注意深く調整する
標本の向きを注意深く調整します。十分な切り出しにより、ほとんどの試料で平坦な表面が保証されます。包埋を実行するスタッフは、各標本の記述をすぐに参照でき、適切にトレーニングされています。
包埋の向きが間違っています。再包埋が必要になるため、組織が失われる可能性があります。切り出しが不十分な標本では、必要な部位の切片を取得するためにミクロトームで広範なトリミングを必要とする場合があります。
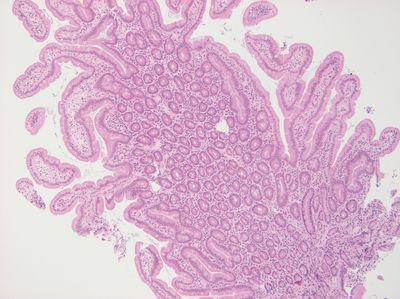
ステップ26 - 適切なモールドを選択する
常に各標本に適したサイズのモールドを選択します。
すべての標本に同じモールドサイズを使用します。組織がモールドの端に触れることがよくあります。


ステップ27 - 標本を丁寧に取り扱う
包埋時には標本を丁寧に取り扱います。
標本は、包埋時に、モールド内に平らに置くために、乱雑に処理されています。このプロセスによって組織が割れる場合があります。
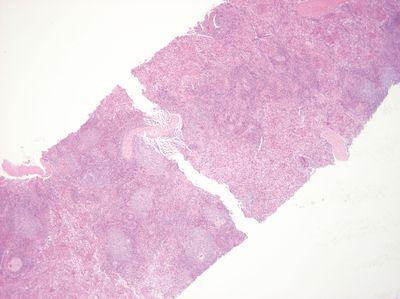
ステップ28 - 過度の熱を避ける
組織を取り扱う前に、パラフィンの融解温度と同じ温度までピンセットを加熱します。
ピンセットはパラフィンワックスの融点をはるかに超えて加熱されています。これにより、接触点に近いところで局所的な熱損傷や形態の変化が起こる可能性があります。
ステップ29 - 定期的に温度を確認する
包埋センターのホットプレートとパラフィンワックスリザーバーの温度を定期的にチェックします。
包埋センターのホットプレートの温度をチェックしたことがありません。この処理段階でも、標本は局所的な過度の熱によって損傷する可能性があります。
ステップ30 - モールドに過剰充填しない
モールドは最適レベルまで充填され、オーバーフローしていません。
モールドが過剰に充填されているため、ミクロトーム(薄切)の前にカセットの背面と端をこすり落とす必要があります。過剰充填されたブロックは、ミクロトームチャックにまっすぐに取り付けられない可能性があり、これが不安定性の原因となり、薄切中に組織が損傷を受ける可能性があります。

この記事の原文はこちら
About the presenter

Geoffrey Rolls is a Histology Consultant with decades of experience in the field. He is a former Senior Lecturer in histopathology in the Department of Laboratory Medicine, RMIT University in Melbourne, Australia.
References
- Clayden EC. Practical section cutting and staining. Edinburgh: Churchill Livingstone, 1971.
- Hopwood D. Fixation and fixatives. In Bancroft J and Stevens A eds. Theory and practice of histological techniques. New York: Churchill Livingstone, 1996.
- Carson FL. Histotechnology. 2nd ed. Chicago: ASCP Press, 2007.
- Winsor L. Tissue processing. In Woods A and Ellis R eds. Laboratory histopathology. New York: Churchill Livingstone, 1994;4.2-1 - 4.2-39.
Leica Biosystems Knowledge Pathway content is subject to the Leica Biosystems website terms of use, available at: Legal Notice. The content, including webinars, training presentations and related materials is intended to provide general information regarding particular subjects of interest to health care professionals and is not intended to be, and should not be construed as, medical, regulatory or legal advice. The views and opinions expressed in any third-party content reflect the personal views and opinions of the speaker(s)/author(s) and do not necessarily represent or reflect the views or opinions of Leica Biosystems, its employees or agents. Any links contained in the content which provides access to third party resources or content is provided for convenience only.
For the use of any product, the applicable product documentation, including information guides, inserts and operation manuals should be consulted.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.