
Técnicas especiales de tinción para la evaluación de mucinas

Las tinciones especiales que se utilizan para la evaluación de mucinas, moléculas similares a la mucina y otras macromoléculas que contienen carbohidratos siguen teniendo demanda y se utilizan con frecuencia en los laboratorios de histología. Este artículo está concebido como una revisión básica de los mecanismos de acción de las tinciones especiales de mucina más utilizadas, como el azul alcián, la mucicarmina, el hierro coloidal y la técnica del ácido peryódico de Schiff . Para comprender estos mecanismos, sin embargo, conviene revisar primero la estructura básica y la química de las mucinas.
Introducción
Las mucinas son glicoproteínas de alto peso molecular que se encuentran dispersas por los epitelios del tracto gastrointestinal, respiratorio y reproductivo. Las mucinas se componen de un núcleo proteico central con múltiples cadenas de carbohidratos (polisacáridos) unidos. El contenido de carbohidratos de la molécula de mucina puede representar el 60-80 % del peso molecular de la molécula. El núcleo de la proteína contiene un alto contenido de los aminoácidos serina y treonina. Una estructura que define a las mucinas es la presencia de repeticiones en tándem de secuencias de aminoácidos específicas dentro del núcleo de la proteína. Desde una perspectiva molecular, las mucinas se clasifican en familias distintas (Muc 1, Muc 2, Muc 3, etc.) en función de las diferencias en la secuencia y el tamaño de las repeticiones en tándem.
Existen otras moléculas de glicoproteínas que comparten similitudes estructurales con las mucinas y a menudo se confunden con estas. Los proteoglicanos son complejos de glucoconjugados de alto peso molecular que se encuentran en altas concentraciones dentro de la matriz extracelular, así como en los tejidos conectivos. En la literatura más antigua, los proteoglicanos se denominan con frecuencia mucinas de tejido conjuntivo. Sin embargo, la estructura (en particular el núcleo proteico de los proteoglicanos) es diferente y distinta de la de las mucinas.
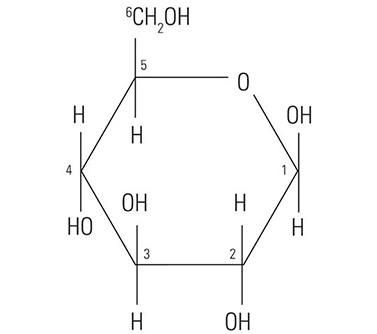
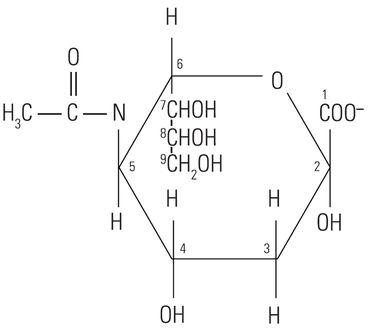
El núcleo proteico de la mucina tiene poca o ninguna influencia sobre la reactividad histoquímica de las mucinas con los tintes utilizados en técnicas de tinción especiales. De hecho, la reactividad histoquímica depende en gran medida de la composición de carbohidratos de las mucinas. La palabra “carbohidrato” se acuñó hace más de cien años para describir una diversa familia de moléculas de la fórmula general Cn(H20)n. La palabra “carbohidrato” en realidad es descriptiva de la proporción 1:1 de las moléculas de carbono respecto al agua (hidrato). La molécula de glucosa (Figura 1) muestra la estructura del monosacárido carbohidrato típico. Otros monosacáridos similares son la manosa y la galactosa. Estas moléculas no tienen carga, ya que no presentan grupos ionizables en condiciones normales. Por el contrario, otros monosacáridos pueden contener grupos ácidos tales como grupos carboxilo (COOH) y sulfónico (SO3H) que son capaces de ionizarse para conferir una carga negativa general en la molécula. El monosacárido carboxilado ácido N-acetilneuramínico, conocido comúnmente como ácido siálico, se muestra en la (Figura 2). La presencia de estos tipos de grupos funcionales define en parte la posible reactividad con las tinciones histoquímicas.
Desde una perspectiva histoquímica, las mucinas pueden colocarse en una de dos categorías amplias en base a la química y la composición del componente carbohidrato de la mucina. Las mucinas cargadas o “ácidas” contienen carbohidratos con grupos carboxilato (COO-) o sulfonato (SO3). Ambos grupos se ionizan a un pH fisiológico para producir una carga negativa general en estas moléculas de mucina. Las cadenas de carbohidratos de mucinas neutras carecen de grupos ácidos y, por tanto, no tienen carga neta. Las mucinas neutras pueden encontrarse principalmente en los epitelios superficiales del estómago, las glándulas de Brunner del duodeno y el epitelio prostático. Las mucinas ácidas se encuentran ampliamente distribuidas por el tracto gastrointestinal y el tracto respiratorio.
Las típicas tinciones especiales de mucina contienen moléculas de colorante catiónico (con carga positiva) en solución a un pH específico. Esto es cierto en el caso de la mucicarmina, el azul alcián, así como las técnicas metacromáticas más antiguas que utilizaban tintes como el azure A o el azul de toluidina. Las moléculas de colorante catiónico se unen a través de fuerzas electrostáticas a las cadenas de polisacáridos aniónicos carboxilados o sulfatados de las moléculas de mucina.
Mucicarmina
La mucicarmina es una de las técnicas más antiguas para la detección de mucinas. Aunque no se usa con tanta frecuencia como antes, la mucicarmina sigue siendo una técnica valiosa para la evaluación de mucinas ácidas, especialmente las del tracto gastrointestinal. Además, esta técnica también es útil para teñir la cápsula del hongo Cryptococcus neoformans.
La molécula activa de colorante que se encuentra en la tinción con mucicarmina es un complejo quelatos formado entre los iones de aluminio catiónicos y el ácido carmínico. El ácido carmínico es una molécula de colorante natural que se aísla de los cuerpos secos de las hembras de los insectos Coccus cacti. Los cationes de aluminio confieren una carga positiva global al gran complejo de carmín. Aunque se desconocen los mecanismos exactos por el que este complejo tiñe selectivamente las mucinas, las pruebas sugieren que es por atracción electrostática a los grupos aniónicos de las mucinas ácidas. Esta teoría está respaldada por las observaciones de que las zonas del tejido que contienen abundantes mucinas neutras muestran poca o ninguna tinción, mientras que las zonas del tracto gastrointestinal que se sabe que contienen mucinas ácidas normalmente se tiñen abundantemente con la mucicarmina.
Azul alcián
El azul alcián es una molécula planar grande de ftalocianina con un átomo de cobre en el centro. La molécula también contiene cuatro grupos básicos de isotiouronio que tienen carga positiva. La carga positiva transmitida por estos grupos da como resultado la atracción de las moléculas de colorante azul alcián a los sitios aniónicos en las moléculas de mucina. Al igual que la mucicarmina, el azul alcián no tiñe las mucinas neutras.
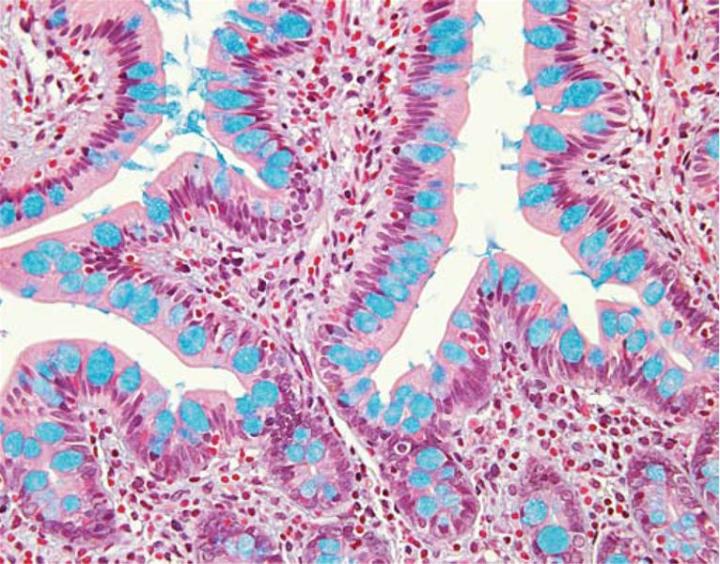
La variación del pH de la solución de azul alcián es un método útil para la caracterización adicional de los subtipos de mucinas ácidas presentes en una muestra de tejido. Todas las mucinas ácidas, ya sean carboxiladas o sulfatadas, se ionizan a un pH de 2,5 para producir grupos aniónicos (COO, SO3). Por lo tanto, el azul alcián estándar (pH de 2,5) tiñe todas las mucinas ácidas (Figura 3). Por el contrario, las mucinas que contienen principalmente carbohidratos carboxilados se tiñen fuertemente con azul alcián a un pH de 2,5 pero no con azul alcián a un pH de 1,0. Los grupos carboxilo no se ionizan a este pH más bajo y, como resultado, las mucinas mostrarán características neutras. Los grupos sulfónicos más ácidos son capaces de ionizar a un pH de 1 y, por lo tanto, se tiñen a este pH.
Hierro coloidal
La técnica del hierro coloidal se basa en la atracción de iones de hierro con carga positiva (cationes férricos) para las terminaciones de grupos de carboxilato y sulfato con carga negativa en mucinas ácidas. Los iones férricos unidos se detectan o visualizan mediante un tratamiento posterior con ferrocianuro potásico para formar depósitos azules brillantes de ferrocianuro férrico o azul de Prusia. Aunque la técnica del hierro coloidal es un método extremadamente sensible para la detección de mucinas ácidas, no se utiliza con tanta frecuencia como otras técnicas como el azul alcián. Sin embargo, al igual que el azul alcián, la técnica del hierro coloidal puede utilizarse en combinación con el ácido peryódico, también conocido como la técnica de Schiff.
La técnica del ácido peryódico de Schiff (PAS)
La técnica de PAS es quizás la más versátil y ampliamente utilizada de las técnicas para la demostración de glicoproteínas, carbohidratos y mucinas. A diferencia de las otras técnicas descritas hasta ahora, la técnica PAS también reconoce mucinas neutras. La reactividad de la técnica PAS no se basa en la presencia de grupos ácidos entre los polisacáridos, sino en la estructura de las unidades monosacáridas.
La técnica PAS se basa en la reactividad de grupos aldehídos libres dentro de las unidades de monosacáridos con el reactivo de Schiff para formar un producto final magenta/rojo brillante. La reacción inicial en la técnica PAS es la oxidación de grupos hidroxilo (OH) unidos a átomos de carbono adyacentes. Estos grupos se denominan glicoles 1,2. La oxidación de estos glicoles da lugar a la formación de grupos aldehídos reactivos de Schiff. En la mayoría de los protocolos, se utiliza como oxidante una solución de ácido peryódico al 0,5 %-1,0 %. La intensidad del color que se desarrolla tras el tratamiento con el reactivo de Schiff es proporcional a la concentración de grupos reactivos glicol 1-2 dentro del tejido. La técnica PAS es particularmente sensible para la detección de mucinas neutras, así como mucinas ácidas que contengan cantidades significativas de ácido siálico. Además de las mucinas, la técnica PAS también se utiliza ampliamente para la detección de glucógeno y varias glicoproteínas. La técnica PAS es particularmente valiosa para la visualización de membranas basales debido a la presencia de glicoproteínas reactivas de Schiff dentro de estas estructuras.
Azul alcián/PAS
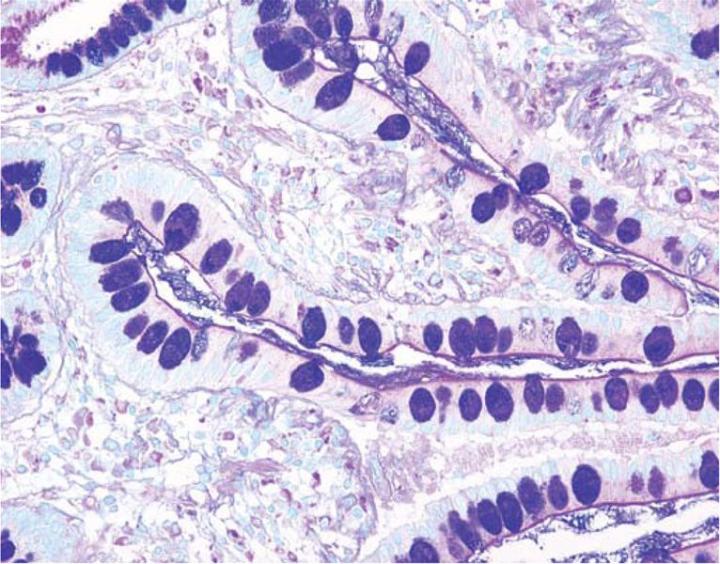
La combinación del azul alcián y las técnicas PAS puede utilizarse como medio para distinguir mucinas neutras de mucinas ácidas. En la mayoría de los protocolos, las secciones se tiñen con el método estándar de azul alcián (pH 2,5) seguido de la técnica PAS. El azul alcián con un pH de 2,5 teñirá todas las mucinas ácidas de color azul intenso, pero no coloreará las mucinas neutras. La posterior aplicación de la técnica PAS teñirá las mucinas neutras de color magenta brillante. Los tejidos o las células que contengan mucinas neutras y ácidas pueden mostrar una coloración azul oscuro o púrpura (Figura 4). La aplicación combinada de azul alcián y PAS es útil por varios motivos. Los cambios en la distribución o el patrón de expresión de mucinas neutras y ácidas son indicativos de ciertas afecciones patológicas. Además, la técnica combinada de azul alcián/PAS es quizás el método más sensible o integral para la detección de mucinas, ya que con esta todas las mucinas deberían reaccionar independientemente de la naturaleza de carga de la mucina.
Figuras
About the presenter

Russell Myers acquired his Ph.D. in endocrine physiology from the Medical College of Georgia. Russell Myers is responsible for design and development of reagents and consumables used in the histology laboratory.
El contenido de Leica Biosystems Knowledge Pathway está sujeto a las condiciones de uso del sitio web de Leica Biosystems, disponibles en: Aviso legal.. El contenido, incluidos los webinars o seminarios web, los recursos de formación y los materiales relacionados, está destinado a proporcionar información general sobre temas concretos de interés para los profesionales de la salud y no está destinado a ser, ni debe interpretarse como asesoramiento médico, normativo o jurídico. Los puntos de vista y opiniones expresados en cualquier contenido de terceros reflejan los puntos de vista y opiniones personales de los ponentes/autores y no representan ni reflejan necesariamente los puntos de vista ni opiniones de Leica Biosystems, sus empleados o sus agentes. Cualquier enlace incluido en el contenido que proporcione acceso a recursos o contenido de terceros se proporciona únicamente por comodidad.
Para el uso de cualquier producto, debe consultarse la documentación correspondiente del producto, incluidas las guías de información, los prospectos y los manuales de funcionamiento.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.