
Spezielle Färbetechniken für die Bewertung von Muzinen

Spezialfärbungen, die zur Bewertung von Muzinen, Muzin-ähnlichen Molekülen und anderen kohlenhydrathaltigen Makromolekülen verwendet werden, bleiben gefragt und werden häufig im histologischen Labor verwendet. Dieser Artikel soll einen grundlegenden Überblick über die Wirkmechanismen der gängigsten Muzin-Spezialfärbungen geben, einschließlich Muzikarmin, Alcianblau, kolloidalen Eisens und der Perjodsäure-Schiff-Reaktion. Um diese Mechanismen zu verstehen, ist es sinnvoll, sich zunächst mit der Struktur und Chemie der Muzine vertraut zu machen.
Einleitung
Muzine sind Glykoproteine mit hohem Molekulargewicht, die sich im Epithel der Atemwege, des Gastrointestinal- und Reproduktionstrakts finden. Muzine bestehen aus einem zentralen Proteinkern, dem mehrere Kohlenhydratketten (Polysaccharide) anhängen. Der Kohlenhydratgehalt eines Muzins kann 60 - 80 % seines Molekulargewichts ausmachen. Der Proteinkern hat einen hohen Gehalt an den Aminosäuren Serin und Threonin. Ein Muzin-definierendes Strukturmerkmal sind die Tandem Repeats spezifischer Aminosäuresequenzen innerhalb des Proteinkerns. Molekularbiologisch und basierend auf den Unterschieden in der Sequenz und Größe der Tandem Repeats lassen sich Muzine in Familien einteilen, die als Muc 1, Muc 2, Muc 3 usw. bezeichnet werden.
Es gibt eine Reihe anderer Glykoproteine, die strukturelle Ähnlichkeiten zu den Muzinen haben und oft mit ihnen verwechselt werden. Proteoglykane sind komplexbildende Glykokonjugate mit hohem Molekulargewicht, die einen wesentlichen Teil der extrazellulären Matrix ausmachen sowie im Bindegewebe vorkommen. In der älteren Literatur werden Proteoglykane zum Teil noch als Bindegewebsmuzine bezeichnet. Bei genauerem Hinsehen allerdings wird deutlich, dass sich die Struktur der Proteoglykane, insbesondere bezüglich des Proteinkerns, von der der Muzine unterscheidet.
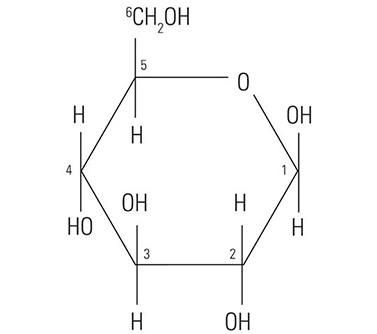
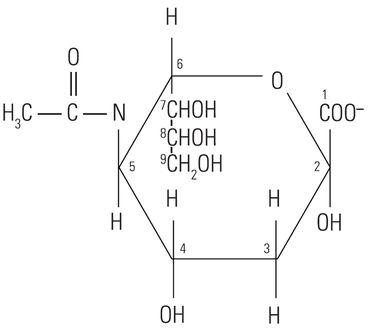
Der Proteinkern der Muzine hat wenig oder gar keinen Einfluss auf die histochemische Reaktivität der Muzine mit den in Spezialfärbungen verwendeten Farbstoffen. Tatsächlich ist diese weitgehend von den Kohlenhydratketten abhängig. Das Wort „Kohlenhydrat“ wurde vor über hundert Jahren geprägt, um eine große und diverse Molekülfamilie zu beschreiben, für die die allgemeine Formel Cn(H2O)n gilt. Eigentlich geht es bei diesem Terminus also um das Eins-zu-Eins-Verhältnis von Kohlenstoff und Wasser (Hydrat). Das Glukosemolekül (Abbildung 1) hat die typische Struktur eines Monosaccharids. Andere, ihm ähnliche Monosaccharide sind Mannose und Galaktose. Diese Moleküle sind nicht geladen, da sie unter Standardbedingungen keine ionisierten Gruppen haben. Im Gegensatz dazu können andere Monosaccharide saure Gruppen wie Carboxyl-(COOH)- und Sulfonsäure-(SO3H)-Gruppen enthalten, die dissoziieren und dabei dem Molekül eine negative Ladung verleihen können. Das carboxylierte Monosaccharid N-Acetylneuraminsäure, das gemeinhin als Sialinsäure bekannt ist, ist in Abbildung 2 dargestellt. Die Präsenz funktioneller Gruppen beeinflusst die Reaktivität der Muzine mit Farbstoffen.
Aus histochemischer Sicht können Muzine einer von zwei breiten Kategorien zugeordnet werden. Entscheidend dafür sind die Zusammensetzung und chemischen Eigenschaften der Kohlenhydratkomponente des Makromoleküls. Die geladenen oder „sauren“ Muzine enthalten Kohlenhydrate mit Carboxylat- oder Sulfonatgruppen (COO-, SO3-). Beide Gruppen liegen bei physiologischem pH-Wert ionisiert vor und sorgen für eine negative Ladung der jeweiligen Muzinmoleküle. Den Kohlenhydratketten von neutralen Muzinen fehlen solche sauren Gruppen. Sie haben daher keine Nettoladung. Neutrale Muzine finden wir hauptsächlich im Oberflächenepithel des Magens, in den Brunner-Drüsen des Duodenums und im Prostataepithel. Die sauren Muzine hingegen sind im gesamten Gastrointestinaltrakt und den Atemwegen präsent.
Die typischen Spezialfärbungen für Muzin enthalten kationische, also positiv geladene Farbstoffmoleküle in einer Lösung mit definiertem pH-Wert. Dies gilt für Alcianblau und Muzikarmin sowie für Azur A und Toluidinblau, die in älteren metachromatischen Techniken Einsatz fanden. Die kationischen Farbstoffmoleküle binden über elektrostatische Kräfte an die anionischen carboxylierten oder sulfonierten Polysaccharidketten der Muzinmoleküle.
Muzikarmin
Muzikarmin ist einer der ältesten Farbstoffe zum Nachweis von Muzinen. Obwohl diese Technik heute nicht mehr so häufig angewandt wird wie früher, ist Muzikarmin immer noch ein wertvolles Instrument zur Bewertung von sauren Muzinen, insbesondere des Gastrointestinaltrakts. Darüber dient die Muzikarminfärbung auch zur Darstellung der Kapsel des Pilzes Cryptococcus neoformans.
Das in der Muzikarminfärbung aktive Farbstoffmolekül ist ein Chelatkomplex aus kationischen Aluminiumionen und Karminsäure. Karminsäure ist Bestandteil eines natürlichen Farbstoffs, der aus den getrockneten Körpern weiblicher Insekten der Spezies Coccus cacti isoliert wird. Die Aluminiumkationen verleihen dem großen Karminkomplex eine insgesamt positive Ladung. Obwohl die genauen Mechanismen der selektiven Muzinfärbung durch diesen Komplex nur wenig verstanden sind, gibt es Hinweise darauf, dass eine elektrostatische Anziehung an die anionischen Gruppen saurer Muzine erfolgt. Diese Hypothese wird durch die Tatsache unterstützt, dass Gewebe, das vor allem neutrale Muzine enthält, kaum Muzikarmin aufnimmt. Im Gegensatz dazu lassen sich jene Regionen des Verdauungstrakts, die für ihren Gehalt an sauren Muzinen bekannt sind, typischerweise stark mit Muzikarmin anfärben.
Alcianblau
Alcianblau ist ein großes, planes Phthalocyanin mit einem Kupferatom im Zentrum. Außerdem enthält das Molekül vier basische Isothiouronium-Gruppen, die eine positive Ladung tragen. Die positive Ladung dieser Gruppen vermittelt die elektrostatische Anziehung der Farbstoffmoleküle an die anionischen Gruppen in Muzinmolekülen. Wie Muzikarmin färbt auch Alcianblau keine neutralen Muzine.
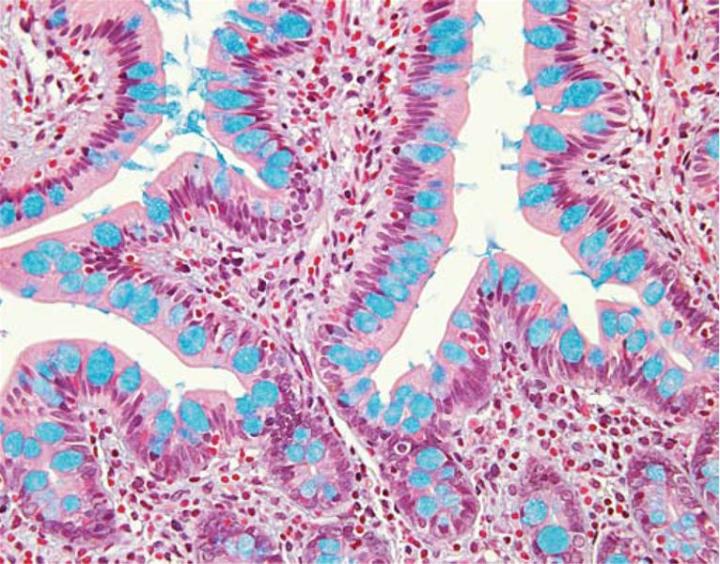
Über eine Variation des pH-Werts der Alcianblau-Lösung lässt sich eine weitere, subtypische Charakterisierung der sauren Muzine in einer Gewebeprobe vornehmen. Alle sauren Muzine, ob carboxyliert oder sulfoniert, liegen bei einem pH-Wert von 2,5 ionisiert vor und tragen anionische Gruppen. Somit färbt das normale Alcianblau, dessen pH-Wert 2,5 beträgt, alle sauren Muzine (Abbildung 3). Im Gegensatz dazu lassen sich Muzine, die überwiegend carboxylierte Kohlenhydrate enthalten, bei einem pH-Wert von 2,5, nicht aber bei einem pH-Wert von 1,0 anfärben. Die Carboxylgruppen ionisieren bei diesem niedrigeren pH-Wert nicht und infolgedessen verhalten sich die Muzine, als wären sie neutral. Die saureren Sulfonatgruppen können auch bei einem pH-Wert von 1,0 noch ionisieren und daher lassen sich stark sulfonierte Muzine auch unter diesen Bedingungen mit Alcianblau anfärben.
Kolloidales Eisen
Die Färbung mit kolloidalem Eisen basiert auf der Anziehung zwischen positiv geladenen Eisenionen (ferrischen Kationen) und den negativ geladenen Carboxylat- bzw. Sulfonatgruppen in sauren Muzinen. Die gebundenen Eisenionen werden durch eine nachfolgende Behandlung mit Kaliumferrocyanid detektiert und sichtbar gemacht, wobei sich intensiv blaues Eisen(III)hexacyanoferrat(II) oder Berliner Blau bildet. Während die Färbung mit kolloidalem Eisen eine hoch sensible Methode für den Nachweis von sauren Muzinen ist, kommt sie seltener zur Anwendung als andere Techniken, wie z. B. Alcianblau. Sowohl Alcianblau als auch kolloidales Eisen lassen sich gemeinsam mit Perjodsäure verwenden. Der Einsatz von Perjodsäure ist auch als Schiff-Technik bekannt.
Perjodsäure-Schiff-Reaktion
Die Perjodsäure-Schiff-Reaktion, kurz PAS-Reaktion, liegt der wohl vielseitigsten und am weitesten verbreiteten Technik zum Nachweis von Glykoproteinen, Kohlenhydraten und Muzinen zugrunde. Im Gegensatz zu den bisher beschriebenen Methoden erfasst die PAS-Technik auch neutrale Muzine. Die Reaktivität der Perjodsäure ist nicht an die Präsenz saurer Gruppen in den Polysacchariden gebunden, sondern von der Struktur der Monosaccharide abhängig, aus denen die Kohlenhydratketten aufgebaut sind.
Diese Monosaccharide enthalten Hydroxyl- oder OH-Gruppen, die unter Einwirkung der Perjodsäure oxidieren und anschließend mit dem Schiff-Reagens reagieren, wobei ein leuchtend rot-violettes Produkt entsteht. Der erste Reaktionsschritt ist also die Oxidation der OH-Gruppen, die den Kohlenstoffatomen im Monosaccharid anhängen. Tatsächlich sind einige Monosaccharide, vor allem Sialinsäure, aufgrund der Anordnung ihrer OH-Gruppen besonders empfindlich für die beschriebene Reaktion. Die Oxidation dieser OH-Gruppen führt zur Bildung Schiff-reaktiver Aldehydgruppen. In den meisten Protokollen wird die Verwendung einer 0,5-1,0%igen Perjodsäure als Oxidationsmittel empfohlen. Die Intensität der Farbe, die sich nach der Behandlung mit dem Schiff-Reagens entwickelt, ist proportional zur Konzentration der reaktiven OH-Gruppen innerhalb des Gewebes. Die PAS-Technik ist besonders sensibel für den Nachweis von neutralen Muzinen sowie sauren Muzinen, die signifikante Mengen an Sialinsäure enthalten. Nicht nur Muzine, auch Glykogen und verschiedene Glykoproteine werden häufig mithilfe der PAS-Technik dargestellt. Besonders wertvoll ist die Methode zur Visualisierung von Basalmembranen, da diese Schiff-reaktive Glykoproteine enthalten.
Alcianblau / PAS
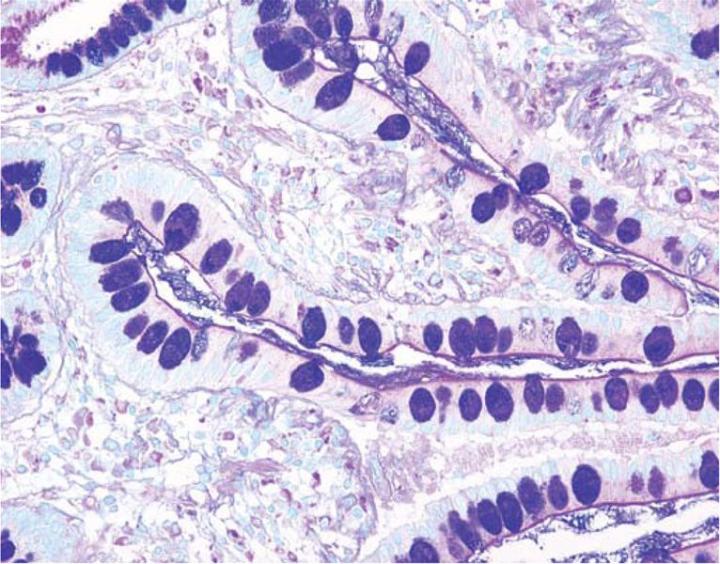
Die Kombination der Alcianblau-Färbung und der PAS-Methode ermöglicht die Unterscheidung von neutralen und sauren Muzinen. Den meisten Protokollen zufolge werden die entsprechenden Schnitte zunächst mit Alcianblau gefärbt und anschließend der PAS-Reaktion unterzogen. Bei einem gegebenen pH-Wert von 2,5 werden die sauren Muzine durch Alcianblau tiefblau gefärbt, die neutralen hingegen nicht. Letztere stellen sich erst dar, wenn das Gewebe auch die PAS-Reaktion durchlaufen hat: Neutrale Muzine erscheinen dann rot-violett. Gewebe oder Zellen, die sowohl neutrale als auch saure Muzine enthalten, können beide Farben aufweisen (Abbildung 4). Die kombinierte Anwendung von Alcianblau und PAS ist aus mehreren Gründen sinnvoll. Veränderungen in der Verteilung oder dem Expressionsmuster von neutralen und sauren Muzinen können auf bestimmte pathologische Zustände hinweisen. Darüber hinaus ist die kombinierte Alcianblau-/PAS-Technik vielleicht die umfassendste und damit sensibelste Methode zum Muzinnachweis, da sie alle Muzine unabhängig von ihrer Ladung erfassen sollte.
Abbildungen
About the presenter

Russell Myers acquired his Ph.D. in endocrine physiology from the Medical College of Georgia. Russell Myers is responsible for design and development of reagents and consumables used in the histology laboratory.
Die Inhalte des Knowledge Pathway von Leica Biosystems unterliegen den Nutzungsbedingungen der Website von Leica Biosystems, die hier eingesehen werden können: Rechtlicher Hinweis. Der Inhalt, einschließlich der Webinare, Schulungspräsentationen und ähnlicher Materialien, soll allgemeine Informationen zu bestimmten Themen liefern, die für medizinische Fachkräfte von Interesse sind. Er soll explizit nicht der medizinischen, behördlichen oder rechtlichen Beratung dienen und kann diese auch nicht ersetzen. Die Ansichten und Meinungen, die in Inhalten Dritter zum Ausdruck gebracht werden, spiegeln die persönlichen Auffassungen der Sprecher/Autoren wider und decken sich nicht notwendigerweise mit denen von Leica Biosystems, seinen Mitarbeitern oder Vertretern. Jegliche in den Inhalten enthaltene Links, die auf Quellen oder Inhalte Dritter verweisen, werden lediglich aus Gründen Ihrer Annehmlichkeit zur Verfügung gestellt.
Vor dem Gebrauch sollten die Produktinformationen, Beilagen und Bedienungsanleitungen der jeweiligen Medikamente und Geräte konsultiert werden.
Copyright © 2024 Leica Biosystems division of Leica Microsystems, Inc. and its Leica Biosystems affiliates. All rights reserved. LEICA and the Leica Logo are registered trademarks of Leica Microsystems IR GmbH.